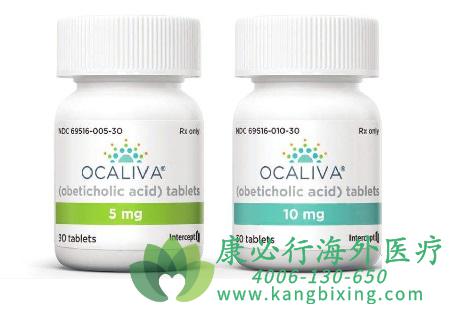
法尼醇X受体(FXR)激动剂——奥贝胆酸(OCA),法尼醇X受体(FXR)是一种核受体,在胆汁酸和代谢调节中起着关键作用。最近的数据表明,FXR的激活也可以改善肝纤维化和炎症。
此前的安慰剂对照临床研究表明,奥贝胆酸(OCA)是一种强效的选择性FXR,短期给药后可改善葡萄糖代谢和NASH的组织学特征,包括肝纤维化。基于先前的3期研究,奥贝胆酸已被批准用于治疗对熊去氧胆酸应答不佳或不能耐受的原发性胆汁性胆管炎(PBC)患者。NASH患者的肝脏相关结局主要发生在肝硬化进展之后;因此,阻止疾病进展至肝硬化是一个关键的治疗目标。考虑到肝硬化进展的时间跨度和临床结局,美国食品药品监督管理局(FDA)和欧洲药物管理局(EMA)均支持基于至少12个月治疗后组织学改善的有条件审批途径。
奥贝胆酸治疗NASH的III期临床试验期中分析,一项名为REGENERATE的III期全球临床试验旨在评估奥贝胆酸治疗对NASH和纤维化的影响。12月5日,The Lancet在线发表了该试验的18个月中期分析结果,全面分析了奥贝胆酸治疗NASH的疗效和安全性。主要结果表明,奥贝胆酸(25 mg)可显着改善NASH患者的肝纤维化。
研究方法,该研究为多中心、随机、双盲、安慰剂对照研究,纳入的成人受试者被确诊为NASH,NAFLD活动度评分(NAS)≥4分;纤维化分期为F2-F3,或F1期纤维化且伴随至少一种共病。
受试者以1:1:1的比例随机分配为3组:每日口服安慰剂(对照组)、奥贝胆酸10 mg(OCA 10mg组)或奥贝胆酸25 mg(OCA 25mg组)。排除标准为:受试者发生肝硬化、其他慢性肝病、酒精消耗增加,或出现其他混杂因素。
临床结局,本研究将治疗第18个月的肝脏组织学作为临床结局的替代终点。
主要终点为:(1)纤维化改善≥1级且无NASH病情恶化(即肝组织没有气球样变性、小叶炎症,或脂肪变性的增加),或(2)在每次肝活检均无肝纤维化恶化的情况下,NASH病情缓解(即病理组织学诊断无脂肪性肝病,或脂肪肝疾病不伴有脂肪性肝炎且NAS积分系统中气球样变性为0分、炎症为0-1分)。
通过分析不良事件、生命体征、心电图(ECGs)和临床实验室评估(包括血脂变化)来评估奥贝胆酸的安全性和耐受性。
研究结果,受试者于2015年12月9日至2018年10月26日期间入组,最终纳入1968例受试者并随机分为三组受试者的基线特征,在ITT人群(n=931)中,各治疗组间的基线特征并无明显差异(表1)。大多数受试者伴有F3期纤维化(54%-58%)和且NAS评分≥6(68%-70%)。与NASH流行病学相一致的是,超过半数的受试者(55%-56%)合并患有2型糖尿病,而在基线时接受降糖药治疗的受试者占52%-55%。此外,41%-46%的患者接受了他汀类药物治疗。
疗效:治疗第18个月时,受试者肝纤维化和NASH的改善情况,治疗第18个月时:(1)OCA 25mg组肝纤维化程度至少改善1级且不伴NASH恶化的患者比例显着高于安慰剂组(23% vs 12%,P=0.0002)。(2)OCA 10mg和25mg治疗组NASH改善且不伴纤维化恶化的患者比例分别较安慰剂组有提高,但是在统计学上并无显着差异。
安全性,1968例受试者中发生的不良事件通常为轻至中度。最常见的不良事件是瘙痒(Pruritus)。总体安全性与以往研究相似,各治疗组的严重不良事件发生率相似[安慰剂组为75例(11%),OCA 10mg组为72例(11%),OCA 25 mg组为93例(14%)]。
REGENERATE研究开始于2015年9月,最初计划全球招募2500例受试者,给药72周(18个月),完成1400例患者入组后进行期中分析。但由于本试验的入组及复合终点的检测需要对患者进行肝脏活检,较难实施,导致患者招募缓慢,试验进展并不理想。
2017年2月,研制奥贝胆酸的药企与FDA进行沟通后获得了FDA的许可,将参加期中分析的患者人数条件从1400人降到750人,同时将试验成功的标准从到达复合终点更改为只要到达其中一个终点。
在试验难度降低之后,药企原本计划在2017年年中进行期中分析,但中期分析结果实际到2019年初才公布。这也从侧面反映了NASH新药临床试验的推进难度,包括患者对疾病的认知不充分,以及NASH药物临床试验的终点设置标准不统一等。
详情请访问 奥贝胆酸 https://www.kangbixing.com



 添加康必行顾问,想问就问
添加康必行顾问,想问就问