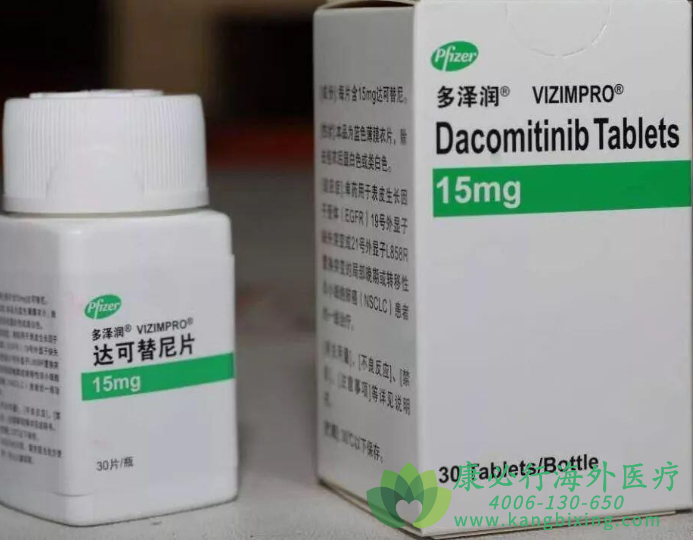
欧盟委员会批准达克替尼(Vizimpro)用于成人局部晚期或转移性EGFR激活突变的非小细胞肺癌(NSCLC)患者的一线治疗。而早在2018年9月,FDA已批准达克替尼用于伴有EGFR外显子19缺失或21号外显子 L858R突变的转移性非小细胞肺癌患者的一线治疗。
意大利AUSL della Romagna-Ravenna肿瘤科主任Federico Cappuzzo博士说:“在过去的20年里,生物标志物驱动的疗法已成为EGFR突变非小细胞肺癌患者的标准疗法。在临床试验中,令人印象深刻的是达克替尼和第一代标准治疗靶向药物相比,显著提高了无进展生存率。”
这项批准基于3期临床试验ARCHER 1050的结果。其中达克替尼降低了40%以上的疾病进展或死亡风险,与晚期EGFR阳性非小细胞肺癌的一线治疗药物吉非替尼(Iressa)相比,达克替尼改善了患者平均6.5个月的反应持续时间。
接受达克替尼治疗的患者,中位无进展生存期(PFS)为14.7个月,吉非替尼组为9.2个月;达克替尼组的平均反应时间(DOR)为14.8个月,吉非替尼组为8.3个月。
2018年ASCO年会上公布的数据还表明,在中位随访期31.1个月时,达克替尼组患者的中位总生存期为34.1个月,而吉非替尼组患者的中位总生存期为26.8个月。
ARCHER 1050通过盲法独立审查设有一个主要终点(PFS),DOR、总反应率(ORR)和安全性作为次要终点。该试验招募了新诊断为IIIB/IV期、EGFR阳性、无中枢神经系统转移的非小细胞肺癌患者,这些患者之前没有接受过系统治疗,包括TKI和ECOG表现状态为0或1.如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 达克替尼 https://www.kangbixing.com/drug/daketini/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问