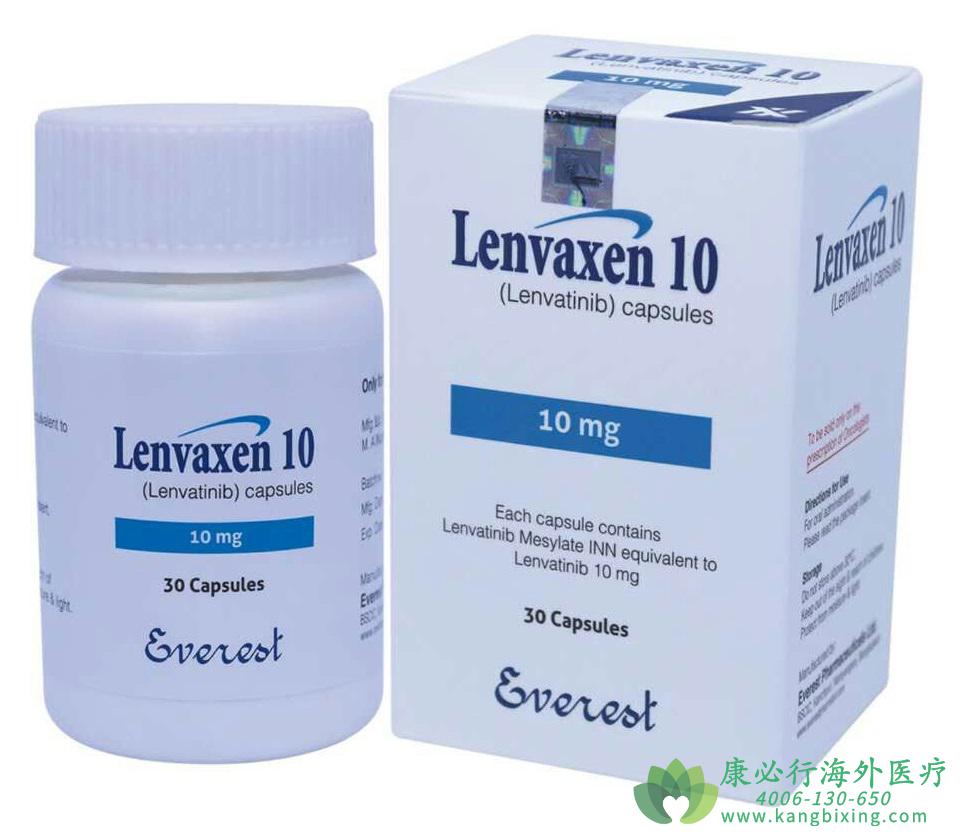
美国FDA日前批准乐卫玛用于治疗放射性碘治疗后进展的难治性分化型甲状腺癌,该药成为继2013年索拉非尼之后第二种获批用于该适应的证口服酪氨酸激酶抑制剂。
乐卫玛这一获批走的是FDA优先审批程序,其通过比预期早两个月,并且和其对应的临床试验结果在同一周发布。Georgetown大学Lombardi综合癌症中心StephenLiu教授评论指出,一直以来,治疗难治性甲癌的方案十分有限,然而目前有两种药物在III期临床试验中表现优异。这些研究证明了我们为罕见癌症设计大型临床试验的能力。FDA一名官员评论指出,FDA的宗旨之一是开发能治疗难治性疾病的药物。乐卫玛该适应证的获批为难治性分化型甲状腺癌患者及临床医生带来了新的治疗选择。
分化型甲状腺癌是甲状腺癌最常见的类型,大约占所有甲状腺癌症的95%。大多数患者治疗疗效很好,但约10%患者会继续进展。据美国国立癌症研究所估计,在2014年,美国有62980例新诊断甲状腺癌病例,1890例死亡病例。
乐卫玛的这一获批是基于SELECT研究结果,该研究纳入392例进展性放射性碘治疗无效的难治性分化型甲状腺癌患者。
所有患者被随机分组分别接受乐卫玛或安慰剂治疗。主要研究终点为中位无进展生存期,试验组为18.3个月,安慰剂组为3.6个月(无进展或死亡HR为0.21,99%CI 0.14-0.31,P<0.001)。此外,试验组中有65%患者肿瘤体积下降,而安慰剂组该比例为2%。
在试验揭盲后,绝大部分安慰剂组的患者开始接受乐卫玛治疗。基于如此高的交叉比率,试验人员认为两组总体生存率将不存在统计学差异。
试验组最常见的副作用是高血压、疲劳、腹泻、关节肌肉痛、食欲减退、体重下降、恶心、口腔炎、头痛、呕吐、蛋白尿、掌足红肿综合征、腹痛、发音困难。FDA指出,乐卫玛可能引发其他严重的副作用,包括心衰、动脉血栓事件、肝毒性、肾衰与肾损、胃肠道穿孔或形成瘘管、QT间期延长、低钙血症、可逆性后部白质脑病综合征、大出血、对胎儿造成影响以及损伤甲状腺激素的抑制功能等。
乐卫玛正等待欧洲以及其他地区的审批,同时也在进行由公司发起的肝癌、肾癌及非小细胞肺癌的临床试验。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 乐卫玛 https://www.kangbixing.com/bxyw/lftn/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问