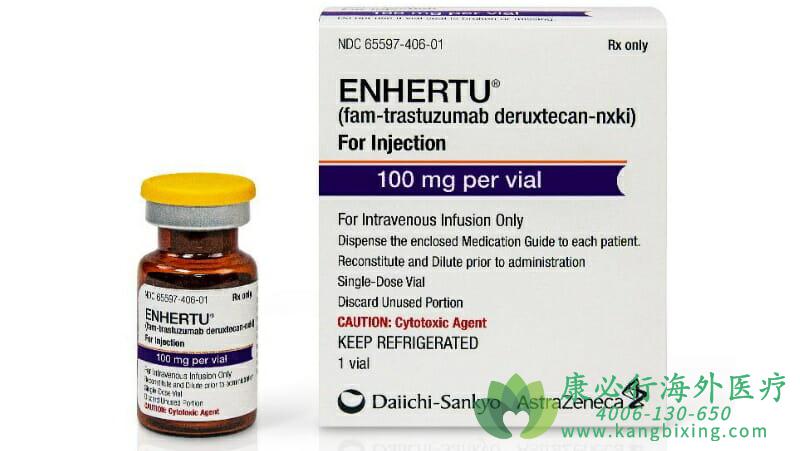
enhertu是一款针对HER2的抗体偶联药物(ADC),FDA的批准基于注册性II期临床试验DESTINY-Breast01的结果。在这项试验中,HER2阳性转移性乳腺癌患者接受Enhertu(5.4毫克/千克)单药疗法。所有患者此前均接受过曲妥珠单抗以及曲妥珠单抗-美坦新偶联物(T-DM1)治疗,有66%的患者同样接受过帕妥珠单抗治疗。
2021年1月15日,FDA批准了fam-trastuzumabderuxtecan-nxki (enhertu)治疗局部晚期或转移性的HER2阳性胃或胃食管腺癌患者,这些患者既往接受过一种曲妥珠单抗为基础的治疗方案。
药物的有效性在一项多中心、开放标签、随机试验中进行了评估,该试验纳入的患者为HER2阳性局部晚期或转移性胃或胃食管腺癌患者,这些患者既往至少接受过2种治疗方案,包括曲妥珠单抗,以及含氟嘧啶和含铂的化疗方案。
188名患者被随机(2:1)分为两组,一组每3周接受enhertu静脉输注6.4mg/kg剂量,或者接受伊立替康或紫杉醇单药治疗。主要的有效性结果评估是由独立中央审查在意向治疗人群中评估的总生存率和客观缓解率。其他的有效性结果评估包括无进展生存和缓解持续时间。
试验结果:
Enhertu组的总生存期为12.5个月,而伊立替康或紫杉醇组的总生存为8.4个月。
Enhertu组的客观缓解率为40.5%,而伊立替康或紫杉醇组的客观缓解率只有11.3%。
Enhertu组的中位无进展生存期为5.6个月,而伊立替康或紫杉醇组中的中位无进展生存期为3.5个月。
enhertu组的中位缓解持续时间为11.3个月,而伊立替康或紫杉醇组中的中位缓解持续时间为3.9个月。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 enhertu https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问