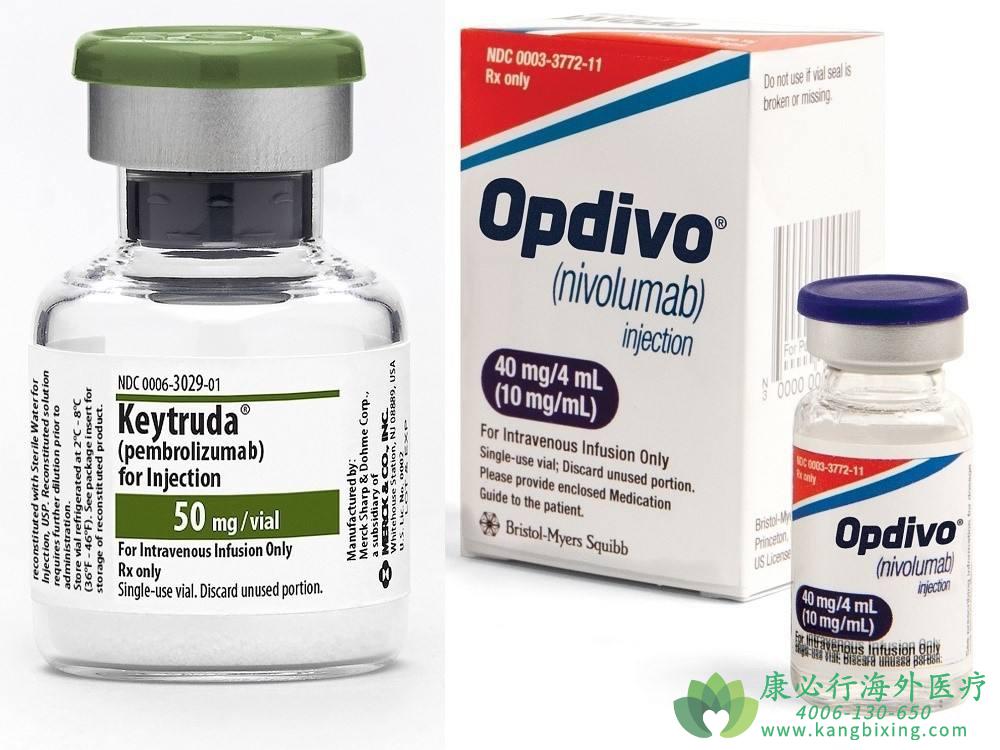
FDA已批准pembrolizuma(Keytruda)的更新剂量时间表,以包括成年患者所有适应症的每6周一次400 mg的选择。新剂量将适用于PD-1抑制剂的所有批准的单药和联合适应症,包括黑色素瘤,默克尔细胞癌,胃癌,肝细胞癌,经典霍奇金淋巴瘤和原发性纵隔大B细胞淋巴瘤。
pembrolizumab(Keytruda)此前的标准给药时间表是每3周200 mg。而加快这次剂量变化与很多因素有关:当前全球疫情蔓延,外出接触变得尤为慎重;由3周一次变为6周一次的给药时间,也为患者增加了方便;而且所有与派姆单抗获批的适应症都可以获批,惠及的患者数可谓之大。
该批准得到了ASCO年会上提出的药代动力学建模和模拟数据的支持; 该试验旨在确定更长的给药间隔是否可以为患者及其医疗保健提供者提供更好的灵活性和可及性。在该试验中,通过检查疗效的两个药代动力学驱动因素(例如给药间隔内的平均浓度(C avg或AUC)和谷浓度(C min))来桥接每6周给药时间表的疗效。
此外,进行了暴露-反应分析以预测黑色素瘤和NSCLC在较长剂量间隔内的总体存活率,以每3周200 mg的标准剂量进行比较。基于建立的暴露-安全性分析,将安全性桥接起来,该分析基于每2周10 mg / kg的最大临床给药和耐受良好的剂量。
结果
数据表明,每6周一次400 mg的给药方案有望在所有临床治疗环境中产生与每3周200 mg(或2 mg / kg)的派姆单抗「相似」相似的功效和安全性。
另外, 基于PBPK模型的Pembrolizumab肿瘤靶点参与的预测表明,每6周400 mg的肿瘤靶标的参与曲线与每3周2 mg / kg或200 mg的相似。在整个给药间隔中,所有剂量均使靶标参与度保持在90%以上。
这两种给药方案具有相似的受益风险曲线,这表明医生可以灵活地按照针对患者需求和/或个人喜好的个性化频率进行给药。
以下是更新后可以选择每6周一次400 mg的给药时间的适应症:
不可切除或转移性黑色素瘤患者;
完全切除后伴有淋巴结转移的黑色素瘤患者的辅助治疗;
用于治疗复发性局部晚期或转移性默克尔细胞癌的成年患者;
成人难治性经典霍奇金淋巴瘤患者,或先前治疗3次或更多次后复发的患者;
成人难治性原发性纵隔大B细胞淋巴瘤或在既往至少两次治疗后复发的成人患者;
复发性局部晚期或转移性胃或胃食管连接腺癌患者,其肿瘤表达PD-L1(CPS≥1);
曾接受索拉非尼(Nexavar)治疗的肝细胞癌患者。
与FDA不同的是,在2019年3月,欧洲委员会已经批准了pembrolizumab所有单药适应症的每6周一次400毫克给药时间表,其中不仅包含上述适应症,还包括非小细胞肺癌,头颈部鳞状细胞癌,尿路上皮癌,微卫星不稳定性–高或错配修复缺陷的实体瘤和子宫颈癌。
更多药品详情请访问 pembrolizuma/Keytruda https://www.kangbixing.com



 添加康必行顾问,想问就问
添加康必行顾问,想问就问