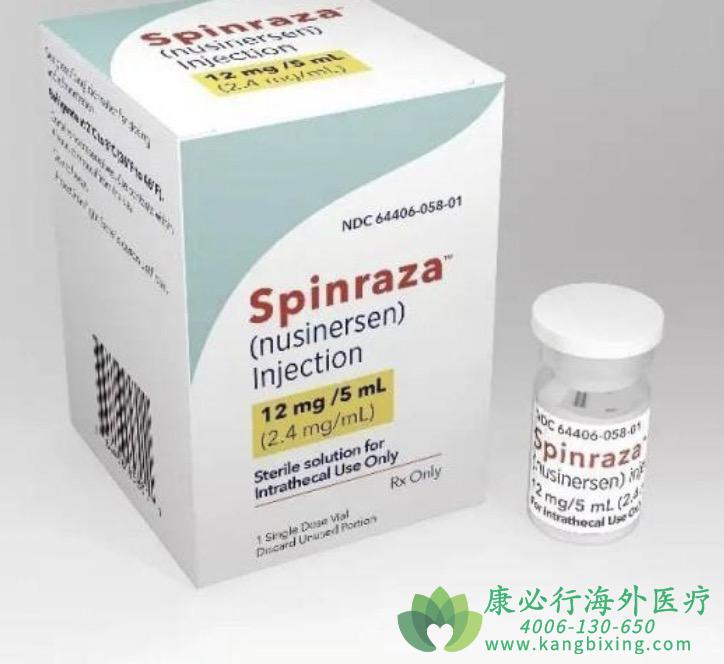
诺西那生纳注射液(SPINRAZA)是由渤健公司(Biogen Idec Ltd)研发SMA治疗药物,2016年12月23日,诺西那生钠注射液首次在美国获批,它是全球首个SMA精准靶向治疗药物,随后该药物已在欧盟、巴西、日本、韩国、加拿大等国家获得批准。
2019年4月28日,诺西那生钠注射液在中国上市,用于治疗5q SMA,并成为中国首个能治疗SMA的药物。5q SMA是该疾病最常见的形式,约占所有SMA病例的95%。
诺西那生纳注射液(SPINRAZA)是一种反义寡核苷酸(ASO),通过鞘内注射给药,将药物直接递送至脊髓周围的脑脊液(CSF)中,增加全功能性SMN蛋白的产生。在SMA患者中,SMN蛋白水平不足导致脊髓运动神经元功能退化。在临床研究中,Spinraza(SPINRAZA)治疗显著提高了SMA患者的运动机能。
2019年5月24日FDA批准诺华制药新型基因疗法Onasemnogeneabeparvovec在美国上市,欧美商品名为Zolgensma.2020年05月19日欧盟委员会(EC)有条件批准基因疗法Zolgensma治疗5qSMA.国内还未开始临床试验。
2018年4月18日,国家药品监督管理局药品审评中心(CDE)承办了罗氏脊髓性肌萎缩症(SMA)口服新药Evrysdi(Risdiplam)的一期临床试验申请,该药是一种小分子SMN2剪接调节剂。2020年04月23日,CDE正式受理治疗脊髓性肌萎缩症(SMA)药物Risdiplam的上市许可申请。Risdiplam如果获得批准,将成为我国首个用于SMA的口服药物。2020年8月7日FDA已经批准Risdiplam上市。
诺西那生纳注射液获得国家药品监督管理局批准,是基于超过300位包括婴儿期发病和迟发的SMA患者参与的SMA领域最大的临床研究数据。NURTURE作为一项渤健公司的全球性临床研究也证实了诺西那生钠注射液治疗SMA症状前婴儿的疗效。NURTURE研究对象为首次服药时年龄不超过6周的婴儿,这些婴儿被基因诊断为患有SMA,但在首次治疗时尚未出现任何症状。NURTURE研究数据显示,更早接受治疗将使SMA症状前婴儿持续获得运动功能改善并实现与正常婴儿发育相一致的运动里程碑。
2018年5月,SMA被列入中国国家卫生健康委员会等部门联合制定的《第一批罕见病目录》,该目录的推出旨在支持罕见病的诊断和治疗。
2018年7月,国家药品监督管理局宣布对在监管体系完善的国家和地区拥有临床研究数据的创新药物可实施优先审评审批程序。
2018年9月,诺西那生纳注射液作为已在境外上市且临床急需的罕见病治疗新药,被国家药品监督管理局纳入优先审评审批程序。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:诺西那生纳常见的不良反应有什么?
更多药品详情请访问 诺西那生纳 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问