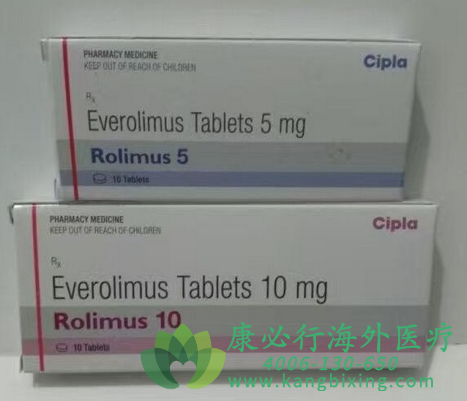
美国食品和药物管理局批准依维莫司(诺华制药公司)用于辅助治疗2岁及以上患有结节性硬化综合症(TSC)相关的部分发作的成人和儿童患者。艾维莫司还被批准用于治疗TSC的其他两种表现:TSC相关的亚独立巨细胞星形细胞瘤(SEGA)和TSC相关的肾血管肌脂瘤。
批准的依据是EXIST-3(NCT01713946),这是一项随机、双盲、多中心的试验,在366名TSC相关的部分发作、用≥2种连续的抗癫痫药物(AED)方案不能充分控制发作,以及TSC诊断(改良的Gomez标准)的患者中进行。此外,符合条件的患者需要在8周的基线阶段在稳定的AED方案下有≥16次部分发作。
患者随机(1:1.09:1)接受以低谷(LT,n=117)或高谷(HT,n=130)浓度的依维莫司或安慰剂(n=119)的依维莫司。患者开始使用依维莫司/匹配的安慰剂治疗,剂量为3至6mg/m2(取决于年龄或根据合并使用的CYP3A4/P-糖蛋白诱导剂进一步调整),每天一次。随后的剂量被滴定以达到目标谷浓度,由一个自动系统指示,以保持研究的盲点。主要的疗效指标是在12周的治疗期间,与8周基线期的每周平均发作量相比,每周平均发作量减少的百分比。试验表明,依维莫司各组的癫痫发作都有明显的减少(LT组29.3%[95%CI:18.8,41.9;P=0.003],HT组39.6%[95%CI:35,48.7;P0.001])>。
最常见的不良反应(在EXIST-3中至少有10%接受依维莫司的患者发生)是口腔炎、腹泻、呕吐、鼻咽炎、上呼吸道感染、脓毒症、咳嗽和皮疹。
本适应症中依维莫司的推荐起始剂量为5mg/m2,口服,每日一次,然后调整剂量(增量不超过5mg)以达到5-15ng/mL的谷浓度。严重肝功能损害的患者或同时服用p-糖蛋白和中度CYP3A4抑制剂的患者应减少依维莫司的剂量。对于同时服用p-糖蛋白和强CYP3A4诱导剂的患者,应增加依维莫司的剂量。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:依维莫司/飞尼妥(EVEROLIMUS)联合依西美坦治疗晚期乳腺癌的效果如何?
更多药品详情请访问 依维莫司 https://www.kangbixing.com/bxyw/ywms/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问