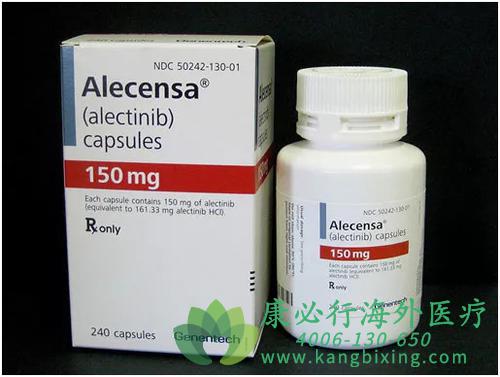
美国食品和药物管理局授予阿来替尼(ALECENSA,Hoffmann-La Roche, Inc./Genentech, Inc.)常规批准,用于治疗由FDA批准的测试所检测出的无性淋巴瘤激酶(ALK)阳性转移性非小细胞肺癌(NSCLC)患者。
阿来替尼获得加速批准,用于治疗ALK阳性转移性NSCLC患者,这些患者在两项单臂试验中,经独立审查委员会(IRC)评估的总反应率(ORR)分别为38%和44%,对克唑替尼有进展或不耐受。
目前的批准是基于ALEX(NCT02075840)的数据,这是一项随机、多中心、开放标签、主动对照的试验,在303名ALK阳性NSCLC患者中进行,这些患者之前没有接受过转移性疾病的系统治疗。所有患者都需要有通过中央实验室检测进行的VENTANA ALK(D5F3)CDx检测确定的ALK重排证据。患者按1:1的比例随机接受阿来替尼 600毫克口服,每天两次(n=152)或crizotinib 250毫克口服,每天两次(n=151)。ALEX证明了无进展生存期(PFS)的改善,经盲法IRC(BIRC)评估,危险比(HR)为0.53(95%CI:0.38,0.73;p0.0001)。
所有患者的中枢神经系统受累都得到了评估。在基线脑扫描有可测量的中枢神经系统病变的43名患者中,经BIRC神经放射学家评估,艾乐替尼组的中枢神经系统ORR为81%(95%CI:58,95),克唑替尼组为50%(95%CI:28,72)。在有可测量的中枢神经系统病变和中枢神经系统反应的患者中,中枢神经系统反应持续时间≥12个月的患者比例在艾乐替尼组为59%,在克唑替尼组为36%。
最常见的不良反应(发生在ALEX中服用阿来替尼的患者中≥20%)是疲劳、便秘、水肿、肌痛和贫血。28%接受阿来替尼治疗的患者发生严重不良反应。导致阿来替尼停药的不良反应发生率为11%。1%或更多的患者发生导致阿来替尼停药的不良反应是肾功能损害、高胆红素血症、丙氨酸氨基转移酶升高和天冬氨酸氨基转移酶升高。19%的阿来替尼治疗的患者因不良反应而发生剂量中断,16%的患者需要减少剂量。艾乐替尼的推荐剂量为600毫克,每日两次,与食物同服。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:阿来替尼/艾乐替尼可显著降低ALK阳性非小细胞肺癌成人患者病情进展?
更多药品详情请访问 阿来替尼 https://www.kangbixing.com/bxyw/altn/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问