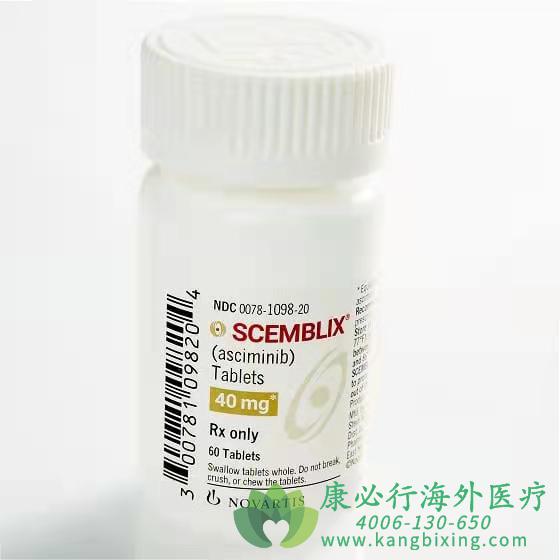
2021年10月29日诺华(Novartis)公司宣布,美国食品药品监督管理局FDA批准STAMP抑制剂Scemblix(asciminib)上市,用于治疗慢性髓系白血病(CML)的2种不同适应症:先前已接受过至少2种酪氨酸激酶抑制剂(TKI)治疗、费城染色体阳性慢性髓性白血病慢性期(Ph+CML-CP)成人患者;携带T315I突变的上述患者(Ph+CML-CP)。
【适应症和用途】
SCEMBLIX是一种激酶抑制剂,适用于治疗以下成年患者:
①先前接受过两种或多种酪氨酸激酶抑制剂(TKI)治疗、处于慢性期(CP)的费城染色体阳性慢性粒细胞白血病(Ph+CML)。
该适应症在基于主要分子反应(MMR)的加速批准下获得批准。对该适应症的持续批准可能取决于验证性试验中对临床益处的验证和描述。
②具有T315I突变的CP中的Ph+CML。
【剂量和给药】
·CP中Ph+CML的推荐剂量:每天一次口服80毫克或每天两次40毫克。
·患有T315I突变的CP中Ph+CML的推荐剂量:200毫克,每天口服两次。
·在服用Scemblix之前至少2小时和之后1小时避免进食。
·整片吞服。不要破碎、压碎或咀嚼药片。
【剂型和规格】
薄膜包衣片:20毫克和40毫克。
【禁忌症】
暂无相关信息。
【警告和注意事项】
骨髓抑制:可能发生严重血小板减少和中性粒细胞减少事件。在治疗期间定期监测全血细胞计数,并通过中断治疗或减少剂量进行管理。
胰腺毒性:监测血清脂肪酶和淀粉酶。中断给药,然后根据严重程度减少剂量恢复给药或中断Scemblix给药。当脂肪酶升高伴有腹部症状时,评估胰腺炎。
高血压:监测血压并按照临床指示管理高血压。如果未对高血压进行药物控制,则中断给药、减少给药或停止SCEMBLIX给药。
超敏反应:可能导致超敏反应。监测患者的体征和症状,并根据临床指示开始适当的治疗。
心血管毒性:可能发生心血管毒性。监测有心血管危险因素史的患者的心血管体征和症状。根据临床指示开始适当治疗。
胚胎-胎儿毒性:可能导致胎儿伤害。告知女性潜在的生殖风险和对胎儿的潜在风险,并使用有效的避孕方法。
【不良反应】
最常见的不良反应(≥20%)是上呼吸道感染、肌肉骨骼疼痛、疲劳、恶心、皮疹和腹泻。
最常见的实验室异常(≥20%)是血小板计数减少、甘油三酯增加、中性粒细胞计数减少、血红蛋白减少、肌酸激酶增加、丙氨酸转氨酶增加、脂肪酶增加和淀粉酶增加。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 Scemblix https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问