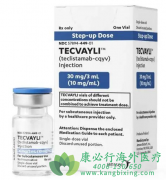
泰立珂(商品名)/特立妥单抗(通用名Teclistamab,代号JNJ-64007957,英文商品名Tecvayli)是一款创新双特异性T细胞接合剂疗法。这款药物针对复发/难治性多发性骨髓瘤(RRMM)患者,提供了新的治疗选择和显著的临床获益。
一、药物机制与靶点
特立妥单抗是一种双特异性抗体,能够同时结合T细胞表面的CD3受体和恶性多发性骨髓瘤细胞表面的B细胞成熟抗原(BCMA)。BCMA是一种肿瘤坏死因子(TNF)受体超家族成员的膜蛋白,在多发性骨髓瘤(MM)细胞上广泛表达,而在正常细胞中几乎没有表达。因此,特立妥单抗通过BCMA/CD3双抗,能够有效地将T细胞“募集”至这一靶病灶区域,并激活T细胞,杀死存在BCMA高表达的癌细胞。
二、临床试验与疗效
特立妥单抗的临床试验数据令人振奋。在I/II期单臂、开放性、多中心的MajesTEC-1试验中,评估了特立妥单抗在复发或难治性多发性骨髓瘤患者中的安全性和有效性。该试验纳入了164例患者,这些患者之前至少接受过三种前期疗法,包括免疫调节剂、蛋白酶体抑制剂和抗CD38抗体,并且疾病仍然出现进展。
试验结果显示,特立妥单抗的总客观缓解率(ORR)达到63%,其中58.8%的患者获得很好的部分缓解或更好缓解(VGPR),39.4%的患者达到完全缓解(CR)或更好缓解。中位持续缓解时间(DOR)为18.4个月,中位无进展生存期(PFS)为11.3个月,中位总生存期(OS)为18.3个月。这些数据表明,特立妥单抗在复发/难治性多发性骨髓瘤患者中具有显著疗效。
三、药物用法与剂量
特立妥单抗的用法为皮下注射,用药前无需稀释。其治疗将从两个递增剂量开始,然后是治疗剂量。对于递增剂量,第1周期第1天(递增剂量1)为0.06mg/kg,第1周期第3天(递增剂量2)为0.3mg/kg,递增剂量之间必须间隔至少2天。治疗剂量的具体方案根据患者的体重和临床反应进行调整。
四、药物副作用与安全性
尽管特立妥单抗在临床试验中显示出显著疗效,但也可能引发一些免疫相关的不良反应。最常见的各级副作用包括细胞因子释放综合征(CRS)、中性粒细胞减少症、贫血、上呼吸道感染、肺炎等。此外,还有可能出现低丙种球蛋白血症、淋巴细胞减少症等免疫系统疾病,以及血小板减少症等血液系统疾病。
然而,这些副作用通常是可控的,并且在密切监测和适当管理下,患者可以安全地接受特立妥单抗治疗。临床试验数据表明,特立妥单抗的安全性总体上是可控的,并且为患者提供了新的治疗选择。
五、药物上市与获批情况
特立妥单抗于2022年8月获得欧盟委员会(EC)批准有条件上市,适应症为单药治疗复发/难治性多发性骨髓瘤成人患者。随后,该药物在美国和中国也相继获批上市,用于治疗复发/难治性多发性骨髓瘤患者。这些批准基于临床试验的积极结果,为特立妥单抗在全球范围内的广泛应用奠定了基础。
六、市场展望与未来方向
随着特立妥单抗在全球范围内的推广和应用,它有望成为复发/难治性多发性骨髓瘤治疗领域的重要药物之一。未来,随着更多临床试验数据的积累和临床经验的丰富,特立妥单抗的适应症可能会进一步扩展,为更多患者带来福音。
同时,我们也期待看到更多创新药物的涌现,共同推动多发性骨髓瘤治疗领域的发展。通过不断的研究和探索,我们有望为患者提供更加有效、安全的治疗方案,改善他们的生活质量,并延长生存期。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 特立妥单抗 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问