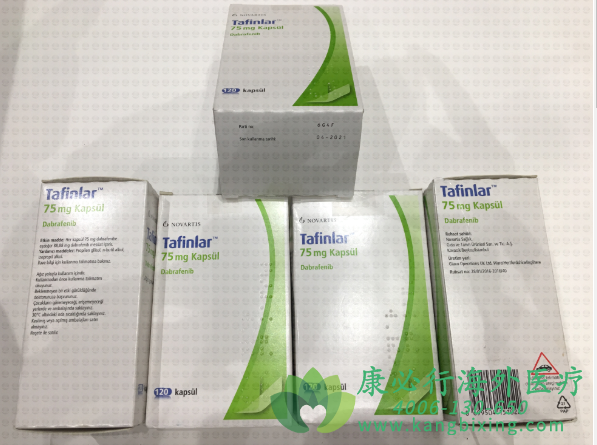
达拉菲尼是一种有些突变形式BRAF激酶的抑制剂。对BRAF V600e和BRAF V600e酶分别有体外IC50值0.65,0.5和1.84 nM.达拉菲尼还抑制野生型BRAF和CRAF激酶有IC50值分别为3.2和5.0nM,和其他激酶例如SIK1NEK11,和LIMK1在更高浓度。在BRAF基因中有些突变,包括那些导致 BRAF V600E,可能导致组成性激活BRAF激酶可能刺激肿瘤细胞生长。在体外和体内达拉菲尼抑制BRAF V600突变阳性黑色素瘤 细胞生长。口服给药后,到达血浆峰浓度中位时间是2小时。口服dabrafenib的均数绝对生物利用度是95%。单剂量后,跨域剂量范围12至300mg达拉菲尼暴露Cmax和AUC以剂量正比例方式增加,但是在重复每天2次给药后增加小于剂量-正比例。在重复每天2次给药150mg平均积蓄比为0.73和在稳态时AUC的受试者间变异性CV%为38%。达拉菲尼与高脂肪餐给药与空腹状态比较,减低Cmax为51%,减低AUC为31%,而延迟Tmax为3.6小时。
2019年12月19日,国家药品监督管理局宣布,诺华肿瘤的达拉菲尼和曲美替尼双靶向联合治疗药物在中国获得上市许可,适用于治疗BRAF V600突变阳性不可切除或转移性黑色素瘤。
达拉菲尼和曲美替尼均为葛兰素史克GSK研发,现归诺华所有。达拉菲尼(泰菲乐)是一种强效和选择性BRAF激酶活性抑制剂。曲美替尼(迈吉宁)是一种可逆的、高选择性MEK1和MEK2激酶活性的变构抑制剂。两者联合治疗,针对BRAF V600突变阳性黑色素瘤的驱动突变靶点,可以使病灶得到快速且显著的缓解,并改善患者的无进展生存。目前,已经在美国、欧盟、日本等多个国家和地区批准上市。
2013年5月29日,美国FDA批准曲美替尼单药治疗BRAF V600E或V600K突变阳性无法切除或转移性黑色素瘤。
2013年8月26日,欧洲药物管理局(EMA)批准达拉菲尼上市。
2014年1月10日,美国FDA批准曲美替尼联合达拉菲尼治疗BRAF V600E或V600K突变阳性无法切除或转移性黑色素瘤。
2018年4月30日,美国FDA批准曲美替尼联合达拉菲尼辅助治疗BRAF V600E或V600K突变阳性黑色素瘤。
双药联合治疗方案在中国的上市,将惠及更多的中国黑色素瘤患者,为他们带来新的希望。诺华肿瘤于年初也递交了达拉菲尼和曲美替尼联合疗法用于BRAF V600突变阳性的III期黑色素瘤完全切除术后辅助治疗的申请,将有望成为国内第一个具有BRAF V600突变黑色素瘤晚期及辅助治疗双适应症的靶向治疗药物。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 达拉菲尼 https://www.kangbixing.com/bxyw/dlfn/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问