礼来(Eli Lilly)宣布,美国食品和药物管理局(FDA)已批准靶向抗癌药玻玛西尼联合内分泌疗法(他莫昔芬或芳香化酶抑制剂),辅助治疗HR+/HER2-高危早期乳腺癌(EBC)成人患者。具体为:淋巴结阳性、复发风险高、经FDA批准的检测方法确定为Ki-67评分≥20%的HR+/HER2- EBC患者。Ki-67是一种细胞增殖的标志物。
值得一提的是,玻玛西尼是第一个也是唯一一个被批准用于上述患者群体的CKD4/6抑制剂。此外,在治疗HR+/HER2- EBC方面,玻玛西尼是近二十年来FDA批准添加至辅助内分泌治疗的首个药物。来自3期monarchE研究的数据显示,在淋巴结阳性、有高复发风险的HR+/HER2- EBC患者中,与标准辅助内分泌疗法(ET)相比,玻玛西尼联合ET治疗使疾病复发风险显示出统计学意义和临床意义的降低。
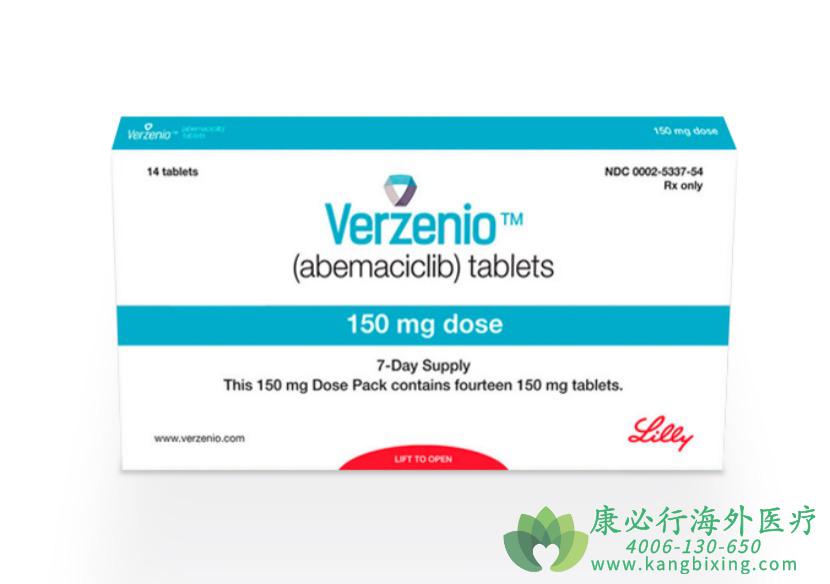
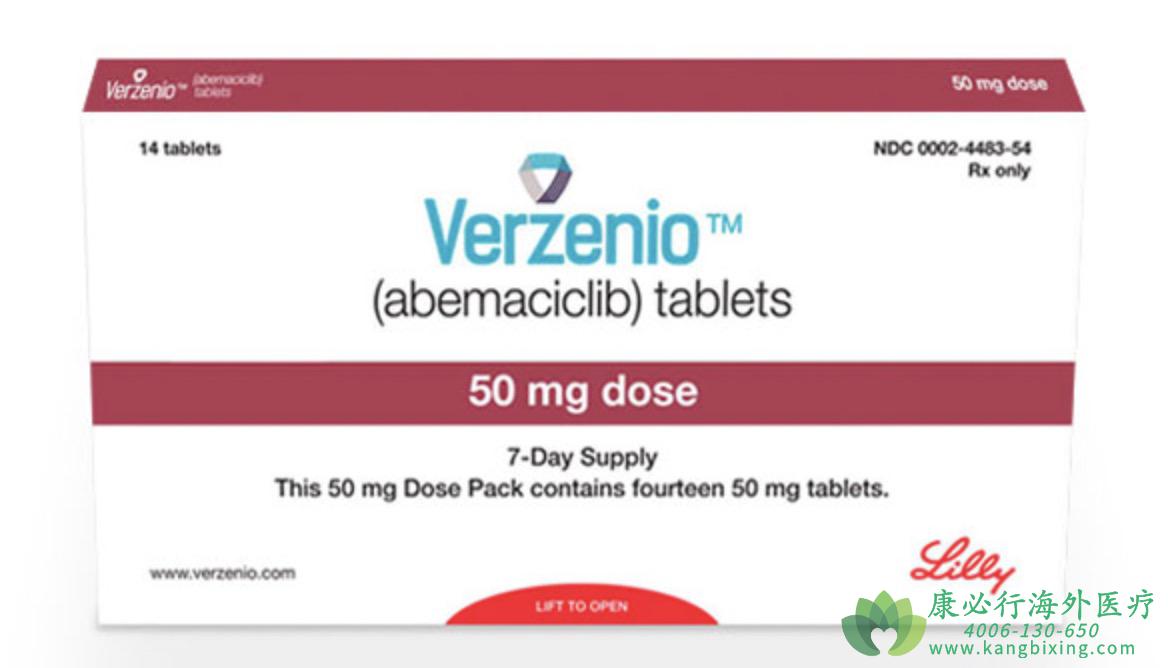
此次FDA批准建立在玻玛西尼现有证据的基础上,该药先前已被批准用于治疗某些类型的HR+/HER2-晚期或转移性乳腺癌。在此次批准的同时,FDA还扩大了玻玛西尼在所有适应症中的使用,当与内分泌疗法(ET)联合使用时,纳入男性患者。玻玛西尼片剂规格有200mg、150mg、100mg、50mg.
monarchE是一项随机(1:1)、开放标签、两队列、多中心3期试验,入组对象为HR+/HER2-、淋巴结阳性、已切除EBC成年男性和女性患者,这些患者存在与高复发风险相一致的临床和病理性特征。试验中,患者以1:1随机分为2组,一组接受玻玛西尼(150mg,每日2次)联合标准辅助ET治疗,另一组接受标准辅助ET治疗,治疗为期2年。在治疗期结束后,所有患者将根据医生指导继续接受ET治疗5-10年。该试验的主要终点是无侵袭性疾病生存期(IDFS)。
该试验在意向性治疗(ITT)人群中进行第二次中期分析时已达到了主要终点:与ET治疗组相比,玻玛西尼+ET治疗组IDFS有统计学意义的显著改善、乳腺癌复发风险降低了28.7%(HR=0.713;95%CI:0.583,0.871;p=0.0009)。
在ITT人群中达到主要终点后,对具有高风险临床和病理学因素以及Ki-67评分≥20%的患者进行了预先指定的IDFS分析。该亚组(n=2003)包括≥4个腋窝淋巴结(ALN)阳性、或1-3个阳性ALN且3级疾病和/或肿瘤≥5厘米、Ki-67评分≥20%。结果显示,在这一预先指定的亚组患者中,与ET治疗组相比,玻玛西尼+ET治疗组IDFS也有统计学意义的显著改善、乳腺癌复发风险降低了35.7%(HR=0.643;95%CI:0.475,0.872;p=0.0042)。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:玻玛西尼/阿贝西利(ABEMACICLIB)的临床试验数据和不良反应介绍?



 添加康必行顾问,想问就问
添加康必行顾问,想问就问