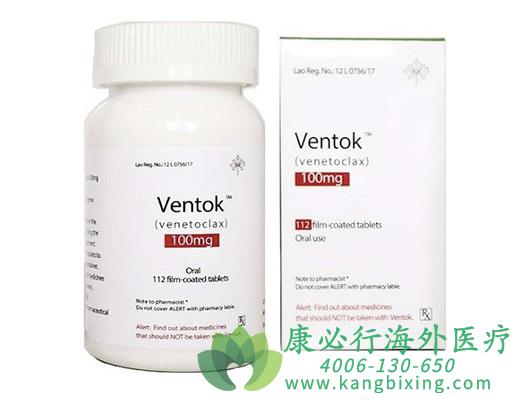
美国食品与药物管理局(FDA)批准新药维奈托克(venclexta)用于治疗之前接受至少1次治疗的17p缺失慢性淋巴细胞白血病(CLL)患者。维奈托克是首个FDA批准的BCL-2蛋白靶向治疗药物,BCL-2蛋白促进癌细胞增殖,在多数CLL患者中高表达。一项涉及106例之前接受至少1次治疗、17p缺失CLL患者的单臂临床试验就该药的有效性进行了评估。受试者每天接受维奈托克口服,从20mg开始逐渐加大剂量,为期5周增加到400mg.结果显示,80%的受试者肿瘤达到完全缓解(CR)或部分缓解(PR)。
维奈托克最常见的副作用为中性粒细胞减少、腹泻、恶性、贫血、上呼吸道感染、血小板减少和乏力。严重的并发症为肺炎、中性粒细胞减少性发热、发热、自体免疫性溶血性贫血、贫血和肿瘤溶解综合征所表现的代谢异常。对于上文所提及的适应证,FDA批准了维奈托克“突破性疗法”资格认定,并进入优先审核和加速审批程序。维奈托克也获得“孤儿药”资格认定。
FDA药品评估和研究中心血液学和肿瘤学产品办公室主任表示,17p缺失的CLL患者现在有了针对维持肿瘤细胞存活的蛋白进行抑制的新靶向治疗药物。对于某些不能从其他治疗中获益的CLL患者,维奈托克可能为这种特殊人群提供一种新的治疗选择。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 维奈托克 https://www.kangbixing.com/drug/wntk/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问