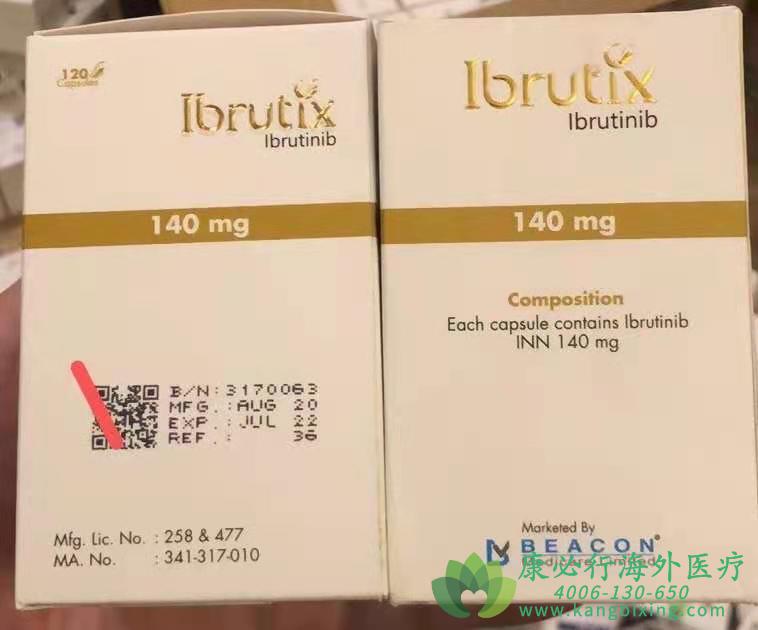
依鲁替尼(Ibrutinib)作为一种Michael受体,可选择性地与布鲁顿酪氨酸激酶(Bruton’s tyrosine kinase,BTK)的半胱氨酸残基(Cys-481)形成共价键。该激酶是至少三种关键B-细胞生存机制的重要介质。布鲁顿酪氨酸激酶的这种多重作用可以使其指挥B-细胞恶性肿瘤进行入淋巴组织,使肿瘤细胞能够接触必要的微环境而得以生存。FDA先后批准依鲁替尼(Ibrutinib)多个适应症,包括套细胞淋巴瘤,小淋巴细胞淋巴瘤,慢性淋巴细胞白血病(CLL),移植物抗宿主病,Waldenström的巨球蛋白血症,边缘区淋巴瘤。
1、套细胞淋巴瘤(MCL)在研究PCYC-1104-CA(简称研究1104)(NCT01236391)中,对依鲁替尼的安全性和有效性进行了评估。试验共入组了111名先前接受过至少一次治疗的MCL患者。所有患者每次接受依鲁替尼560mg,每日一次,直到疾病进展或出现不可耐受的毒性反应。入组患者的人群特征为:中位年龄68岁,77%为男性,92%为白人。在基线时,89%的患者ECOG评分为0或1。既往治疗的中位次数为3次,其中11%的患者接受过干细胞移植。39%的受试者至少有一个5厘米的肿瘤,49%的受试者有骨髓受累,54%的受试者在筛查时有结节外受累。本次试验主要观察终点为研究者评估的客观反应率(ORR)。试验结果表明,所有患者的ORR为65.8%,CR为17.1%,PR为48.6%,中位DOR为17.5个月。独立审查委员会(IRC)评估的ORR为69%,平均反应时间为1.9个月。
2、慢性淋巴细胞白血病/小细胞淋巴瘤依鲁替尼治疗CLL/SLL患者的安全性和有效性在一项非对照试验和四项随机对照试验中得到证实。研究PCYC-1102-CA(简称研究1102)(NCT01105247)是一项开放的多中心试验,对48例CLL患者进行了研究。入组患者的人群特征为:中位年龄67岁,71%为男性,94%为白人。所有患者的ECOG基线评分为0或1。先前治疗的中位次数为4次。46%的受试者至少有一个≥5厘米的肿瘤。所有患者每次接受依鲁替尼420mg,每日一次,直到疾病进展或出现不可耐受的毒性反应。本次试验主要观察终点为ORR和DOR。试验结果表明,所有患者的ORR为58.3%,均为部分反应。所有患者都没有完全恢复。DOR的范围从5.6个月到24.2个月以上。中位数DOR未达到。
3、边缘区淋巴瘤(MZL)依鲁替尼在MZL中的安全性和有效性在研究PCYC-1121-CA(简称研究1121)(NCT01980628)中进行了评估,该研究是一项开放标签、多中心、单臂试验,对象是接受过至少一次先前治疗的患者。入组患者的人群特征为:中位年龄66岁,59%为女性,84%为白人。92%的患者基线ECOG评分为0或1,8%的患者基线ECOG评分为2。既往治疗中位次数为2次。所有患者接受依鲁替尼每次560 mg,每日一次。试验结果表明,所有患者的ORR为46%,CR为3.2%,PR为42.9%,中位DOR为NE(not estimable未评估)。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 依鲁替尼 https://www.kangbixing.com/bxyw/yltn/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问