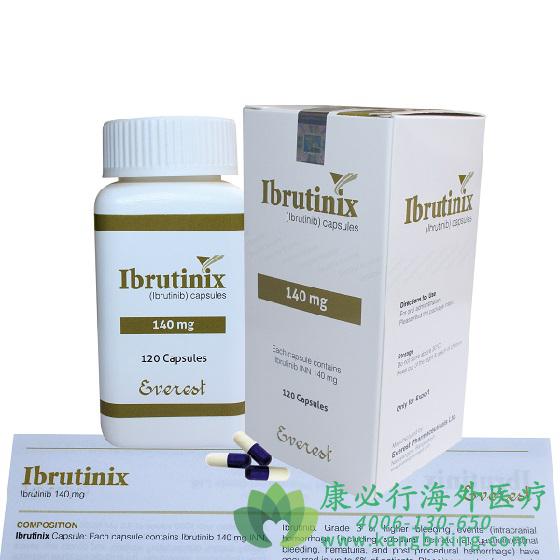
当癌细胞主要位于血液和骨髓中时,疾病被称为CLL,当癌细胞主要位于淋巴结中时,疾病称为SLL.CLL/SLL是成人中最常见的白血病种类。这是一种影响淋巴细胞的血液癌症。日前,美国FDA宣布,批准艾伯维(AbbVie)和杨森(Janssen)公司联合开发的重磅BTK抑制剂伊布替尼(ibrutinib,英文商品名Imbruvica)扩展适应症,与CD20单克隆抗体利妥昔单抗(rituximab)联用,作为初始疗法治疗慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)成人患者。伊布替尼和利妥昔单抗都是治疗CLL/SLL的重要获批疗法。2019年,伊布替尼已经获批与另一款CD20单克隆抗体Gazyva(obinutuzumab)联用,成为首个治疗CLL/SLL初治患者的一线非化疗组合疗法。这项新的批准为CLL/SLL初治患者提供了更多治疗选择。
这一批准是基于名为E1912的随机、多中心、开放标签、含活性对照组的3期临床试验,529例70岁以下初治CLL/SLL成人患者以2:1的比例分为两组,分别接受伊布替尼+利妥昔单抗组合疗法,或由氟达拉滨、环磷酰胺和利妥昔单抗(FCR)构成的组合疗法。这些患者中不包括染色体17p缺失的患者。试验结果表明,与接受FCR的患者相比,接受伊布替尼联合利妥昔单抗治疗的患者的无进展生存期(PFS)出现统计学显著改善(HR=0.34;95% CI:0.22,0.52;p<0.0001)。在中位随访时间为49个月时,中位总生存期(OS)尚未达到,Imbruvica组3%的患者死亡,FCR组7%的患者死亡。
“对于身体较为健康,能够耐受强力治疗手段的CLL患者来说,通过静脉输液接受FCR化学免疫组合疗法是很多患者一线疗法选择中的金标准,今天的批准改变了这一现状,”CLL协会首席医学官兼执行副总裁说:”FDA的这一批准对寻求非化疗治疗选择的初治患者来说是个好消息。今天的这一里程碑代表着医生治疗CLL患者范式的改变,可能让更多患者接受非化疗选择。”如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 伊布替尼 https://www.kangbixing.com/bxyw/yltn/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问