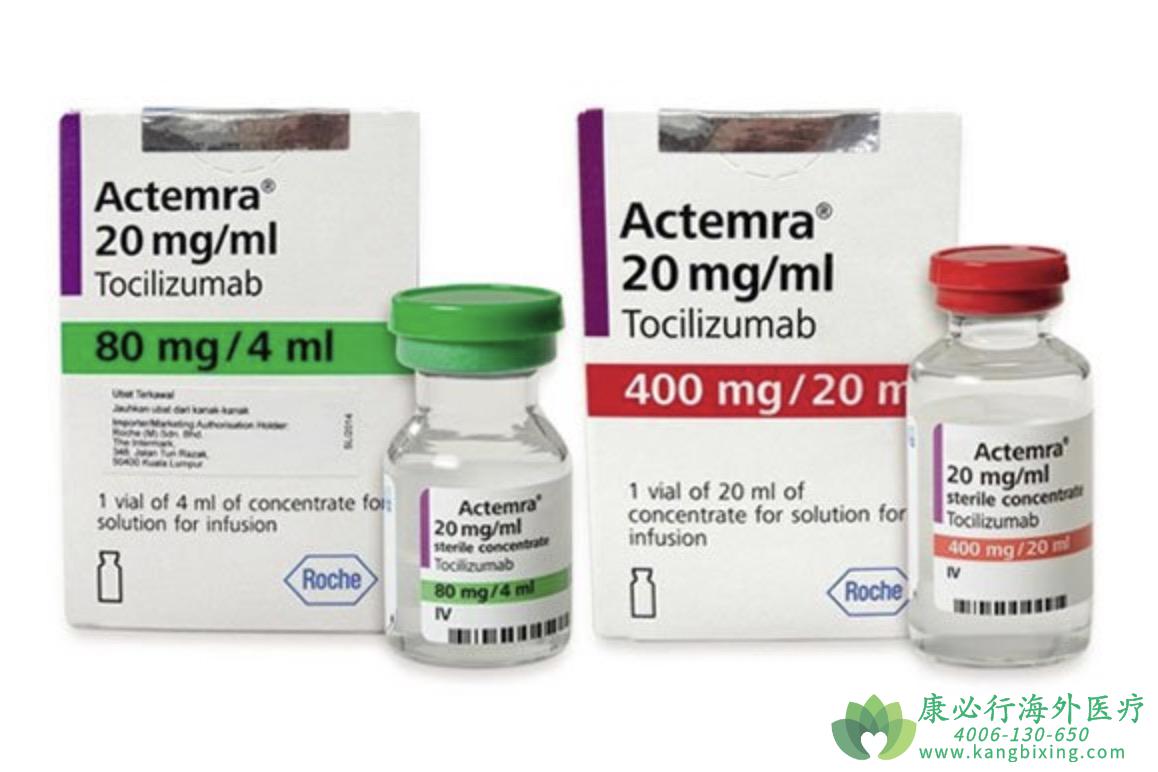
Actemra是首个人源化白细胞介素6受体拮抗剂单克隆抗体,可通过静脉输注(IV)和皮下注射(SC)2种方式给药,该药已获全球多个国家批准用于中度至重度活动性类风湿性关节炎(RA)成人患者的治疗。Actemra可单独用药或与甲氨蝶呤(MTX)联合用药,用于对其他抗风湿药物不耐受或无响应的成人患者。此外,Actemra静脉注射配方(IV)已获全球主要市场批准用于2岁及以上幼年特发性关节炎(pJIA)或全身性幼年特发性关节炎(sJIA)患者的治疗。在欧洲,Actemra也已获批用于既往未使用甲氨蝶呤(MTX)治疗的严重活动性进展性类风湿性关节炎(早期RA)成人患者的治疗。
系统性硬化症(SSc),也称为硬皮病,是一种破坏性的自身免疫性疾病,随着时间的推移,病情恶化,无法治愈。当免疫系统失灵导致皮肤和肺部组织增厚和硬化时,就会发生这种疾病。全世界约有250万人患有SSc。间质性肺病(ILD)可能发生在大约80%的SSc患者中,引起肺部炎症和瘢痕,并可能危及生命。
罗氏(Roche)近日宣布,美国食品和药物管理局(FDA)已批准IL-6受体抑制剂Actemra/RoActemra(中文商品名:雅美罗,通用名:tocilizumab,托珠单抗)皮下注射液,用于延缓系统性硬化症相关间质性肺病(SSc-ILD)成人患者肺功能下降的速度。
此次批准,基于focuSSced试验的数据。这是一项随机、双盲、安慰剂对照3期临床试验,入组了212例系统性硬化症(SSc)成人患者。
在212名随机进入focuSSced研究的患者中,Actemra/RoActemra组68名患者(65%)、安慰剂组68名患者(64%)在基线检查时存在SSc-ILD,这一点通过盲法胸部放射科医生对高分辨率计算机断层扫描(HRCT)的目测结果证实。该研究开展了事后探索性分析,以评估有和无SSc-ILD的患者亚组中的结果。总体人群的ppFVC和FVC结果主要由SSc-ILD亚组的结果驱动。在该亚组中,Actemra/RoActemra组患者的平均ppFVC下降幅度小于安慰剂组(0.07%vs-6.4%,平均差异:6.47%)、FVC下降幅度小于安慰剂组(平均变化:-14毫升vs-255毫升,平均差异:241毫升)。与安慰剂组相比,Actemra/RoActemra组患者改良Rodnan皮肤评分(mRSS)从基线检查到第48周的平均变化较大(-5.88 vs-3.77,平均差异:-2.11)。
在focuSSced研究中,Actemra/RoActemra治疗48周的安全性在SSc-ILD患者和SSc患者中总体安全性相当。在focuSSced研究和faSScinate研究中,Actemra/RoActemra的安全性与该药已知的安全性一致。Actemra/RoActemra治疗的患者中,最常见的不良事件是感染。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 Actemra https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问