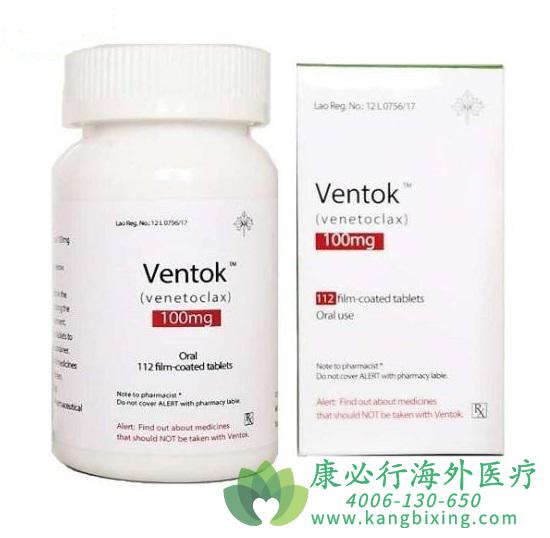
FDA已批准抗癌药维纳托克(商品名:Venclexta)与阿扎胞苷、地西他滨或低剂量阿糖胞苷(LDAC)联用,治疗75岁或以上新确诊或因并发症无法接受强力诱导化疗的急性髓系白血病(AML)患者。此外,美国国家综合癌症网络(NCCN)指南建议:将维纳托克和阿扎胞苷联合使用,作为不适合进行强力化疗的1类AML患者的首选治疗方案。
急性髓系白血病(AML)是最常见的白血病类型之一,其特征是大量的异常细胞在骨髓和血液中快速增殖,导致造血功能受到干扰,最终发展成癌。AML多发生于65岁以上的中老年人,疾病进展迅速,是最具侵略性和最难治疗的血癌之一。如果不及时治疗,通常会在数周或数月内死亡,生存率极低。尽管现有的疗法已有了很大进步,但确诊AML的患者5年生存率仍不足30%。目前,AML主要以强力诱导化疗为主,患者几乎没有其他治疗选择。但由于AML通常会迅速恶化,由于年龄因素或并发症,并非所有患者都能接受强力诱导化疗。对于无法接受标准化疗或化疗不耐受的老年患者,主要考虑造血干细胞移植,临床可选择的治疗方案更少,亟需更好的疗法。
维纳托克是全球首个获批上市的针对B细胞淋巴瘤-2因子(Bcl-2)的口服靶向药,可选择性结合并抑制BCL-2蛋白,BCL-2是一种抑制细胞凋亡的蛋白。维纳托克是通过抑制Bcl-2作用,激活内源性线粒体凋亡通路,进而导致癌细胞死亡,减缓疾病进程。2016年,FDA已批准维纳托克上市,用于治疗慢性淋巴细胞白血病(CLL)患者和小淋巴细胞淋巴瘤(SLL)患者。2018年,该药曾获得FDA加速批准,用于治疗新诊断或不符合化疗条件的AML患者患者。而今,维纳托克已在包括美国在内的50多个国家/地区获得批准,但尚未在国内上市。
FDA的这一完全批准是基于一系列试验数据,包括两项3期试验VIALE-A(M15-656)和VIALE-C(M16-043)。VIALE-A是双盲、安慰剂对照、多中心的3期临床试验,入组的431名患者随机分配。旨在评估维纳托克联合阿扎胞苷(n = 286)在不符合标准诱导化疗条件的患者中的疗效和安全性,主要终点是OS.目前,该试验结果已发表在第25届欧洲血液学协会(EHA)年会和《新英格兰医学杂志》上。
结果表明:与阿扎胞苷 + 安慰剂相比,维纳托克 + 阿扎胞苷治疗组患者死亡风险降低了34%。治疗组的中位OS为14.7个月,而安慰剂组仅为9.6个月,增加了近半年。与阿扎胞苷 + 安慰剂相比,治疗组的患者的完全缓解率(CR)达到了37%,CR + CRh(完全缓解伴部分血液学恢复)为65%;而安慰剂组CR仅为18%,CR + CRh率为23%。VIALE-C 3期试验共有211名患者参加,评估了维纳托克联合LDAC(n=143)与安慰剂 + LDAC(n=68)的疗效和安全性。主要终点是OS.该试验数据已在2020年美国临床肿瘤学会(ASCO)年会和EHA年会上发表。
结果显示:与安慰剂 + LDAC相比,维纳托克联合LDAC的中位OS为7.2个月VS 4.1个月。治疗组的CR率为27%,中位CR持续时间为11.1个月,而安慰剂组的CR率仅为7.4%,中位CR持续时间为8.3个月。维纳托克联合LDAC组的CR + CRh率为47%,安慰剂组为15%。两组试验CR或CRh的首次缓解中位时间均为1.0个月。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:维纳托克/维奈托克可用于不适合进行强化学疗法的新诊断AML患者?
更多药品详情请访问 维纳托克 https://www.kangbixing.com/drug/wntk/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问