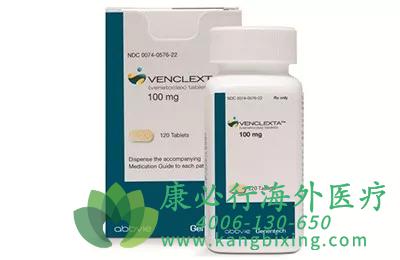
维奈妥拉是一款突破性药物,是艾伯维肿瘤产品组合中的核心产品,也是美国FDA批准的首个BCL-2抑制剂用于治疗白血病,已获FDA授予的5项突破性疗法认定。2020年该药在中国获批的适应症为多发性骨髓瘤(MM)。维奈妥拉是一款全球首创的口服、选择性B细胞淋巴瘤因子-2(BCL-2)抑制剂。BCL-2在细胞凋亡中发挥重要作用,且在某些类型癌症中过度表达,与耐药的形成相关,是血液癌症治疗的一个新靶标。Venetoclax旨在选择性抑制BCL-2功能,重塑细胞的关键信号通路,让癌细胞自我毁灭,达到治疗肿瘤的目的。
2016年4月,维奈妥拉在美国首次获批。其获批是基于一项2期临床研究(M13-982)的积极数据,该研究在携带del 17p突变的复发性或难治性慢性淋巴细胞白血病(CLL)患者中开展。数据显示,维奈妥拉单药治疗总缓解率(ORR)高达79.4%,达到了研究的主要终点。一年无进展生存率和总生存率分别为72%和86.7%。2018年6月,艾伯维与罗氏旗下基因泰克(Genentech)宣布,美国FDA已通过优先审评批准维奈妥拉与rituximab联合使用,治疗经治的CLL或小淋巴细胞性淋巴瘤(SLL)患者。Rituximab是一款CD20单抗。研究表明,相比标准治疗方案,该联合治疗能显著减少疾病进展或死亡的风险达81%。2018年11月,维奈妥拉再度获批,用于与低甲基化剂或低剂量阿糖胞苷化疗联用,治疗新确诊75岁以上,或因为慢性健康问题和疾病无法使用高强度化疗的急性骨髓性白血病(AML)患者。此外,该产品针对其它恶性血液肿瘤如多发性骨髓瘤(MM)、非霍奇金淋巴瘤(NHL)和骨髓增生异常综合征(MDS)的临床研究正在进行中。
此次最新获批临床的适应症为多发性骨髓瘤(MM)。这是一种恶性肿瘤,其特征在于骨髓中浆细胞异常增殖。公开数据显示,在恶性血液肿瘤中,MM发病率仅次于非霍奇金淋巴瘤,是第三大常见血液肿瘤,全球每年新增病例约11.4万例,仅25%的患者接受化疗后生存期在5年以上。
过去几十年,全球已有20多款药物获批治疗多发性骨髓瘤,包括一些蛋白酶抑制剂、免疫调节剂等,它们为提高MM患者生存率做出了很多大的贡献。然而,和很多其他恶性癌肿一样,大部分MM患者经多次治疗后,会出现复发、耐药等情况。对于患者来说,仍然需要更为安全有效的药物。因此,治疗多发性骨髓瘤的创新机制的药物目前仍然是临床急需。
目前,艾伯维正在全球开展一项3期临床研究BELLINI,试验在既往已接受1-3线疗法并且对蛋白酶抑制剂敏感或初治的复发性或难治性MM患者中开展,评估硼替佐米与地塞米松联合维奈妥拉的疗效和安全性。早前结果显示研究达到了无进展生存期主要终点(中位PFS:22.4个月 vs 11.5个月),同时显著提高了总缓解率(ORR:82% vs 68%)。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:维奈克拉/维奈托克(VENETOCLAX)治疗骨髓增生异常综合征的疗效如何?
更多药品详情请访问 维奈妥拉 https://www.kangbixing.com/drug/wntk/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问