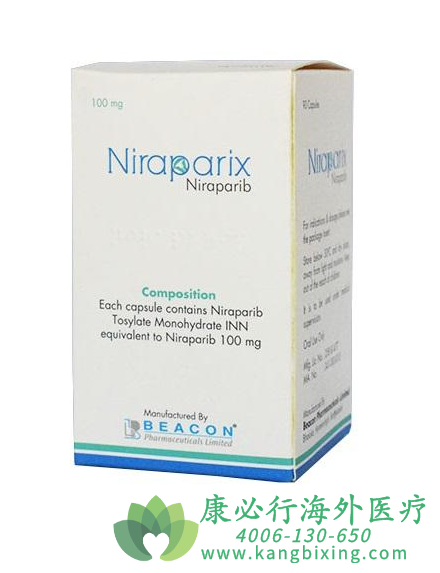
2020年9月10日,国家药品监督管理局(NMPA)批准尼拉帕利的补充新药上市申请,用于一线含铂化疗完全或部分缓解的所有(不论其生物标志物状态如何)上皮性卵巢癌、输卵管癌或原发性腹膜卵巢癌成人患者维持治疗。尼拉帕利此次新适应证的获批主要基于国际III期临床研究PRIMA(ENGOT-OV26/GOG-3012),该研究的结果已于2019年ESMO年会上公布,并同步发表在顶尖医学期刊《新英格兰医学杂志》。
NOVA研究已经证实了尼拉帕利维持治疗在所有铂敏感复发的卵巢癌患者中具有显著获益,PRIMA研究旨在检验在复发风险较高的新诊断的晚期卵巢癌患者接受一线铂类化疗后,尼拉帕利维持治疗的疗效和安全性。研究共纳入733例患者,这些患者在以铂类为基础的化疗达到PR/CR后,被分为两组,分别接受尼拉帕利(n=484)或安慰剂(n=244)治疗,其中5例未接受随机分组治疗。研究结果如下:
在整体人群中,尼拉帕利组的中位PFS较安慰剂组显著延长5.6个月(13.8个月vs 8.2个月),疾病进展或死亡风险降低38%(HR=0.62)。尼拉帕利组和安慰剂组1年PFS率分别为53%和35%。
在BRCA阳性患者中,尼拉帕利组的中位PFS约是安慰剂组的两倍(22.1个月对10.9个月);同时,与安慰剂相比,尼拉帕利可显著降低患者的疾病进展或死亡风险60%(HR=0.40)。
在HRD阳性患者中,尼拉帕利组的中位PFS较安慰剂组延长11.5个月(21.9个月对10.4个月),疾病进展或死亡风险降低57%(HR=0.43)。
在HRD阴性患者中,尼拉帕利组的中位PFS同样较安慰剂组显著延长(8.1个月对5.4个月),疾病进展或死亡风险降低32%(HR=0.68);在这一组患者中进行的中期OS分析显示,尼拉帕利组和安慰剂组估计的2年OS率分别为81%和59%,与安慰剂相比,尼拉帕利可使疾病死亡风险降低49%(HR=0.51)。
PFS的生物标志物亚组分析是研究预设的探索性分析,结果表明,在所有生物标志物各组中,尼拉帕利治疗的患者PFS显著延长。
安全性方面,PRIMA研究与尼拉帕利既往的研究相似,安全可控,没有发现新的安全性信号。
PRIMA研究表明,尼拉帕利用于一线维持治疗疗效良好,可全人群获益。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:PARP抑制剂尼拉帕利/尼拉帕尼(NIRAPARIB)的用药注意事项有哪些?
更多药品详情请访问 尼拉帕利 https://www.kangbixing.com/bxyw/nlpn/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问