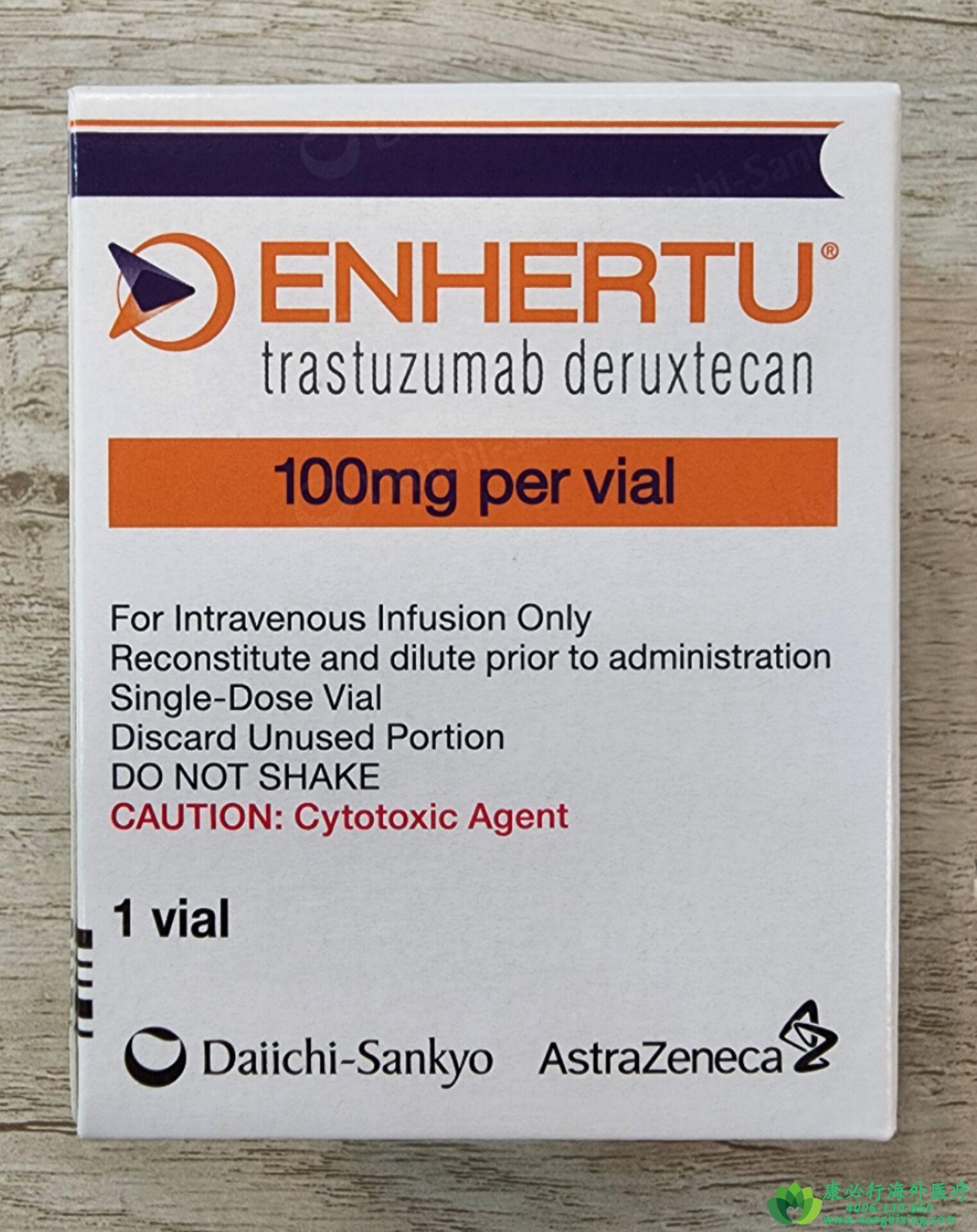
FDA批准抗体偶联药物(ADC)Enhertu(Trastuzumab deruxtecan(T-DXd))新适应症,用于治疗无法切除或转移性HER2低表达(HER2-low)乳腺癌患者。HER2低表达定义为免疫组化(IHC)评分为1+或IHC评分为2+且原位杂交结果为阴性。
Enhertu是靶向HER2的抗体药物偶联物(ADC),由阿斯利康和第一三共共同开发和商业化。基于DESTINY-Breast04研究结果显示,与化疗相比,Enhertu将疾病进展或死亡风险降低了50%,并提升患者总生存期(OS)六个月以上。
此次获得FDA批准基于DESTINY-Breast04 III期试验结果。相比医生选择的化疗方案,Enhertu将HER2低表达转移性乳腺癌患者疾病进展或死亡风险降低了50%(中位无进展生存期[PFS]9.9 vs 5.1个月),接受Enhertu治疗的患者中位总生存期(OS)为23.4个月,而化疗患者的中位总生存期(OS)为16.8个月,死亡风险降低了36%。
美国纪念斯隆凯特琳癌症中心肿瘤内科医生Shanu Modi说:“大约一半的乳腺癌患者属于HER2低表达,既往归为HER2阴性,并且没有有效的HER2靶向药物治疗方案。基于DESTINY-Breast04试验结果,临床医生开始重新界定HER2低表达,及思考如何将可能从Enhertu治疗中获益的HER2低表达乳腺癌患者筛选出来。”
阿斯利康肿瘤业务部执行副总裁Dave Fredrickson表示:“FDA加速批准Enhertu用于治疗HER2低表达转移性乳腺癌,足以突显该创新药物能够给患者带来的临床获益的紧迫性。通过现有HER2检测方法确定的HER2低表达患者,将有机会根据其HER2状态接受治疗。”
肿瘤业务全球主管兼第一三共公司总裁兼首席执行官Ken Keller表示:“FDA的批准标志着乳腺癌治疗重要时刻的到来,因为Enhertu是有史以来首个批准用于HER2低表达转移性乳腺癌患者的抗HER2靶向药物。依据DESTINY-Breast04试验看到的突破性生存获益,这一里程碑发现证实了在HER2低表达转移性乳腺癌靶向治疗的重要性,我们很高兴能够为更多患者提供Enhertu。”
Enhertu已在美国获得优先审评和突破性疗法资格,该批准是根据 FDA 的实时肿瘤学审查(RTOR)计划授予的。继其先前批准用于 HER2阳性转移性乳腺癌的二线之后,Enhertu 在美国的扩展批准,使其能够更广泛的用于HER2表达乳腺癌患者,包括HER2-低表达患者。
DESTINY-Breast04 III期试验结果在2022年美国临床肿瘤学会年会(ASCO)上发表,并同时发表在了《新英格兰医学杂志》(NEJM)上。Enhertu的安全性与前期临床试验一致,没有发现新的安全性问题。间质性肺病(ILD)或肺炎的发生率与Enhertu用于HER2阳性晚期乳腺癌治疗试验中观察到的一致。总体上,由独立裁决委员会确定,12% 的患者已确认与治疗相关的 ILD 或肺炎。大多数ILD事件为1级或2级(10%),5个3级(1.3%),没有4级事件。有三例(0.8%)ILD相关的死亡事件(5级)。
2022年6月,NCCN指南更新,将Enhertu作为免疫组化(IHC)评分为1+或IHC评分为2+且原位杂交结果为阴性转移性乳腺癌患者的1类首选方案。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 Enhertu https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问