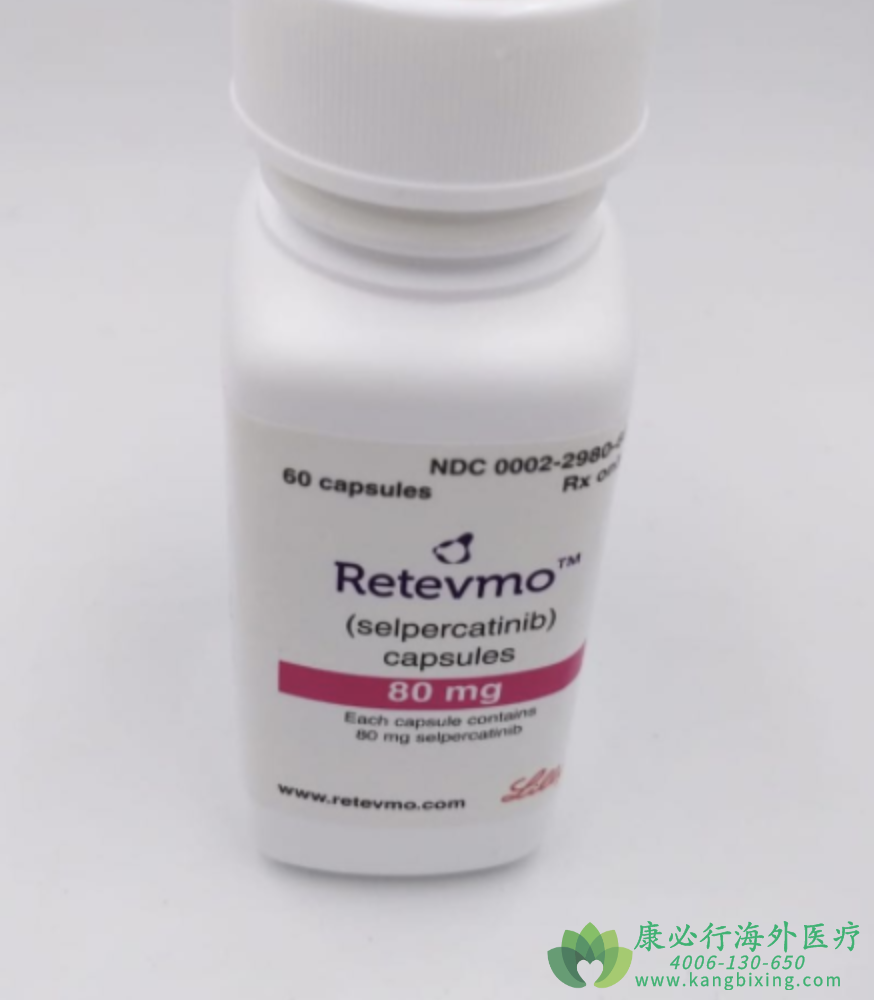
塞尔帕替尼是一种强效、口服、高度选择性、转染期间重排(RET)激酶抑制剂,用于治疗RET异常的癌症患者。RET基因是一个在转染过程中发生重排的原癌基因,并因此而得名,该基因编码一种细胞膜受体酪氨酸激酶,其异常是多种类型肿瘤的罕见驱动因素。塞尔帕替尼旨在抑制天然的RET信号转导以及预期的获得性耐药机制,开发用于治疗肿瘤中携带异常的RET激酶的患者。
礼来(Eli Lilly)近日宣布,美国食品和药物管理局(FDA)已加速批准其精准肿瘤学药物塞尔帕替尼(selpercatinib,塞尔帕替尼,40mg和80mg胶囊):用于治疗在先前系统治疗期间或之后疾病进展、或没有其他令人满意替代治疗选择的、RET基因融合阳性、局部晚期或转移性实体瘤患者。该适应症基于总缓解率(ORR)和缓解持续时间(DOR)数据在加速审批程序下获得批准。
塞尔帕替尼是被批准用于RET基因融合阳性晚期或转移性实体瘤成人患者的RET抑制剂,无论其肿瘤类型如何。支持该项批准的LIBRETTO-001试验的不限癌种(tumor-agnostic)数据显示,在多种类型肿瘤中,塞尔帕替尼治疗的总缓解率(ORR)为44%。
除了上述“不限癌种”适应症,FDA还将塞尔帕替尼的一项加速批准转为了常规批准:用于治疗经FDA批准的一款检测产品证实为RET基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
上述“不限癌种”加速批准和NSCLC常规批准,基于关键性1/2期LIBRETTO-001试验数据的支持。该试验是使用RET抑制剂治疗RET驱动癌症患者的最大规模临床试验。这项多中心、开放标签、多队列研究纳入了包括NSCLC在内的局部晚期或转移性RET驱动实体瘤患者。主要疗效结果为ORR和DOR,由盲法独立审查委员会(BIRC)评估。预先指定的次要终点包括中枢神经系统(CNS)ORR和CNS DOR。
RET融合阳性实体瘤:在“不限癌种”数据集内的41名患者中,最常见的癌症是胰腺癌(27%)、结直肠癌(24%)、涎腺癌(10%)和未知原发癌(7%)。37名患者(90%)之前接受过系统治疗(中位数:2次[范围0-9];32%接受过3次或更多)。
CNS转移RET融合阳性NSCLC患者的疗效结果:(1)先前接受过治疗CNS转移RET融合阳性NSCLC患者中,颅内病灶ORR为87.5%(n=14/16);39%的缓解者颅内DOR≥12个月。(2)初治CNS转移RET融合阳性NSCLC患者中,颅内病灶ORR为80%(n=4/5);38%的缓解者颅内DOR≥12个月。
在LIBRETTO-001安全性评估人群(n=796)中,晚期实体瘤患者最常见的不良反应(≥25%)为水肿、腹泻、疲劳、口干、高血压、腹痛、便秘、皮疹、恶心和头痛。最常见的3级或4级实验室异常(≥5%)淋巴细胞减少,丙氨酸氨基转移酶(ALT)升高,天冬氨酸氨基转移酶升高,钠降低,钙降低。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:塞尔帕替尼(RETEVMO)获批用于晚期或转移性RET融合实体瘤患者?
更多药品详情请访问 塞尔帕替尼 https://www.kangbixing.com/drug/srptn/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问