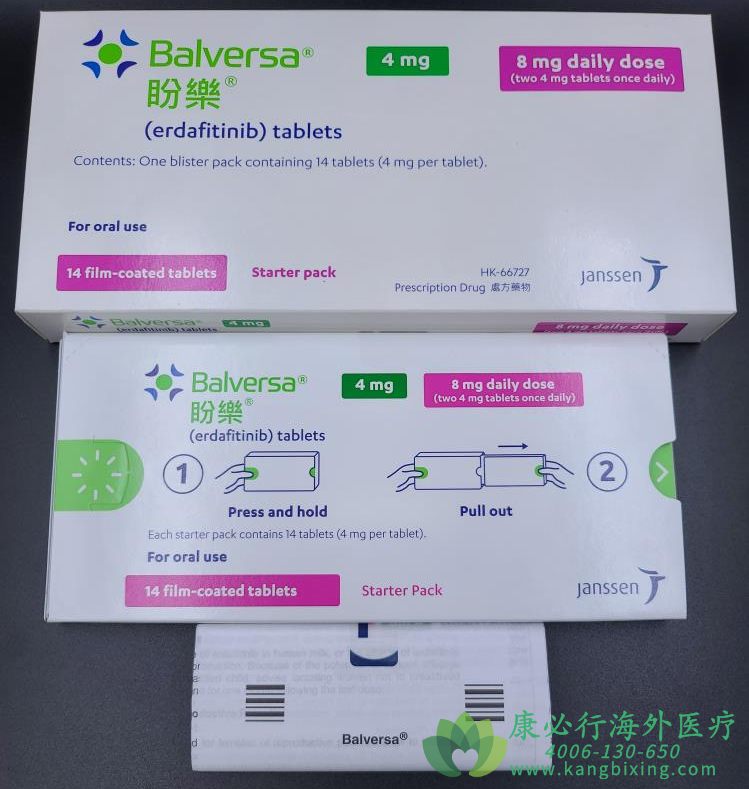
在膀胱癌(尿路上皮癌)中,细胞在膀胱中异常生长形成肿瘤。大多数膀胱癌始于膀胱内层,称为尿路上皮。如果肿瘤扩散到膀胱外,则被认为是晚期膀胱癌。尿路上皮癌(UC)是最常见类型的膀胱癌,约占所有膀胱癌病例的90%以上,其中大约五分之一的转移性UC患者存在FGFR基因改变。靶向药厄达替尼Balversa是转移性膀胱癌首个靶向疗法,已获FDA批准用于携带特定成纤维细胞生长因子受体(FGFR)基因改变的局部晚期或转移性尿路上皮癌成人患者。
在亚洲、欧洲和北美14个国家的126个医疗中心进行开放标签、非对照、2期BLC2001临床研究。招募18岁以上符合条件的患者,患有局部晚期和不可切除或转移性尿路上皮癌,并携带FGFR突变。肿瘤学组体能状态为0-2,至少接受一次全身化疗后或在新辅助或辅助化疗后12个月内发生疾病进展。在研究开始阶段,确定方案为连续每天一次8毫克/天口服厄达替尼,以28天为周期,并提供药效学指导的递增至9毫克/天。主要终点是研究者根据实体瘤反应评估标准1.1版评估的确认客观反应率,厄达替尼的疗效和安全性。
筛选了2328名患者,其中212名入组,101名接受了选定的厄达替尼8毫克/天UpT方案治疗。截止到2019年8月9日。中位随访时间为24·个月(IQR 22·7–26·6)。在101名患者中,研究者评估的接受选定厄达替尼方案治疗的患者的客观缓解率为40%。
安全性概况与主要分析中的相似,在随访报告中没有发现新的安全性相关事件。厄达替尼Balversa的活性药物成分为Erdafitinib,是一种口服FGFR激酶抑制剂。FGFRs是一个受体酪氨酸激酶家族,可以被多种类型肿瘤中的基因改变所激活,这些改变可能导致肿瘤细胞生长和生存率的增加。
厄达替尼Balversa是美国FDA批准的第一种FGFR激酶抑制剂。该药适应症的进一步批准将取决于确认性研究中临床疗效的验证和描述。之前,FDA分别为在2018年3月和2018年9月授予Balversa突破性药物资格(BTD)和优先药物资格。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 厄达替尼 https://www.kangbixing.com/drug/edatini/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问