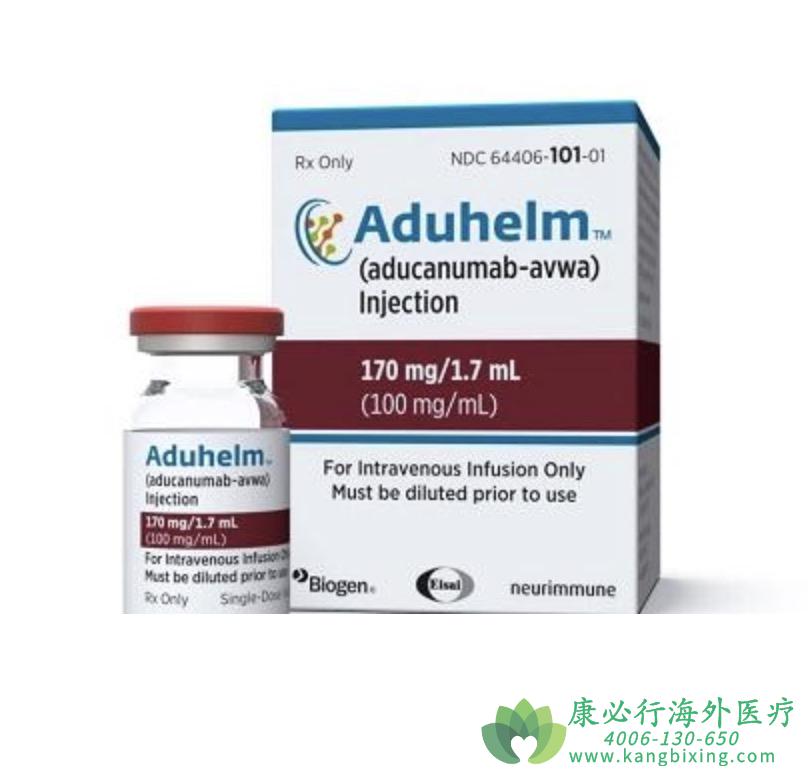
在最初批准Aduhelm作为被诊断患有阿尔茨海默病(AD)引起的轻度认知障碍或轻度AD患者的静脉治疗时,美国FDA就已要求渤健将ENVISION研究作为上市后和加速批准Aduhelm(aducanumab-avwa)的监管条件之一。
ENVISION试验将评估100mg/mL剂量Aduhelm注射液用于早期阿尔茨海默病静脉内使用的治疗效果。该研究是一项全球性的安慰剂对照试验,招募约1500名早期阿尔茨海默病患者并确认其β淀粉样蛋白病理学。试验主要终点是在Aduhelm治疗开始后18个月通过临床痴呆评定量表(CDR-SB)进行测量,此外还将涵盖一项长期扩展研究,收集患者48个月的长期数据进行分析。
次要终点方面,包括淀粉样蛋白正电子发射断层扫描(PET)和Tau PET数量的变化、AD评估量表-认知子量表(ADAS-Cog 13)、AD合作研究-日常生活活动-轻度认知障碍(ADCS-ADL -MCI)、综合AD评定量表(iADRS)、简易精神状态检查(MMSE)和神经精神清单(NPI-10)等。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 Aduhelm https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问