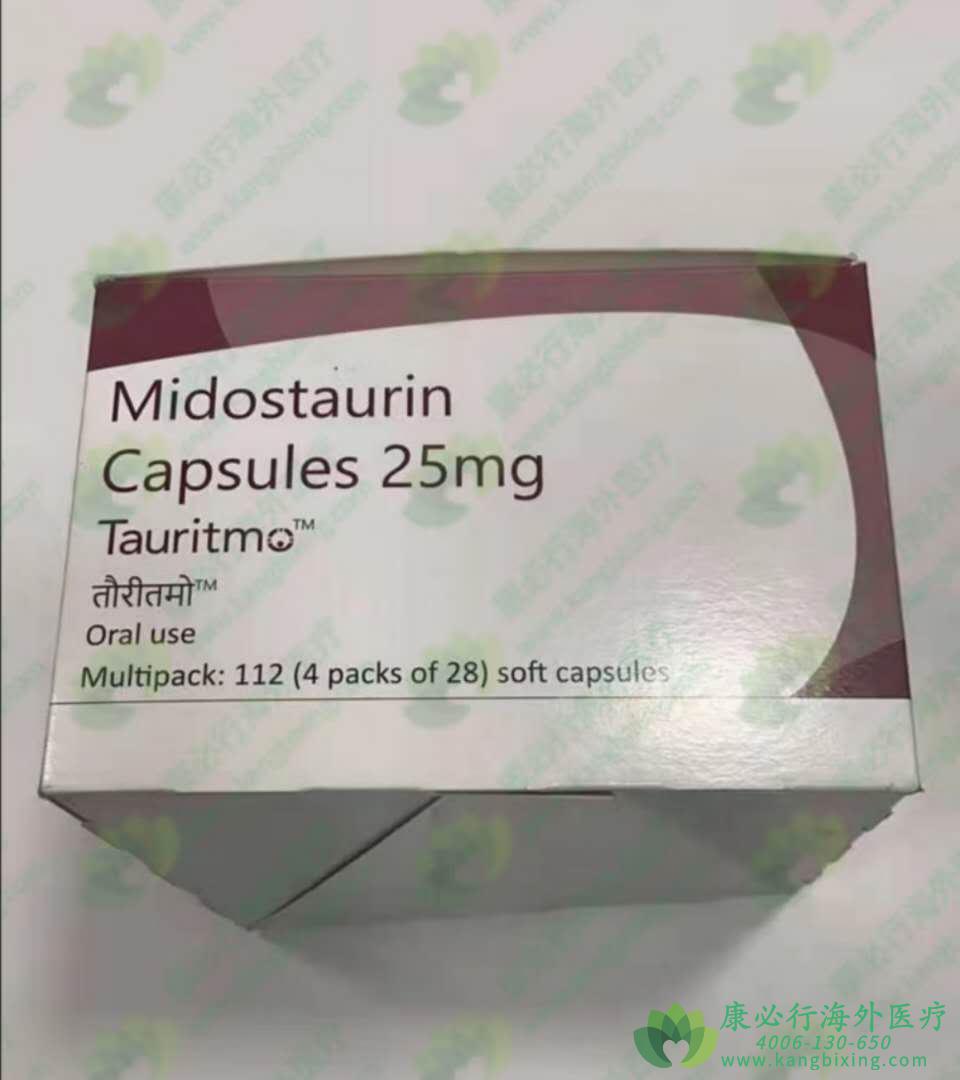
Rydapt(midostaurin)米哚妥林作为一种口服多靶向激酶抑制剂,是通过阻断几种促进细胞增长的酶起作用的,其中包括Flt3,因此被开发用于携带FTL3突变的AML患者的治疗。如果患者在血液或骨髓中检测到FLT3突变,即可考虑使用Rydapt联合化疗进行治疗。2017年4月,美国食品和药品监督管理局(FDA)批准Rydapt与化疗疗法联合使用,治疗新确诊的、有特定基因突变FLT3的急性髓系白血病成年患者,这也使得Rydapt当时成为了美国首个与化疗疗法联合用于治疗急性髓系白血病的靶向药物。与其他急性骨髓性白血病患者相比,FLT3基因突变的患者复发的可能性更高,生存率也更低。以往的治疗选择有限的情况下,由诺华研发的米哚妥林改变了这一临床现状。
此外,FDA还批准了该药物用于治疗罕见血液疾病侵袭性全身性肥大细胞增多症。此前,FDA还曾授予米哚妥林上市申请优先审评资格、快速通道审评资格(用于肥大细胞增多症)及突破性疗法制定(用于急性髓系白血病)。
英国国家健康与护理卓越研究所(NICE)已决定推荐诺华米哚妥林Rydapt(midostaurin)用于治疗侵袭性系统性肥大细胞增多症、伴有相关血液肿瘤或肥大细胞白血病的系统性肥大细胞增多症(统称为AdvSM)。
获得NICE推荐后,米哚妥林成为了英国第一种也是唯一一种获得许可的AdvSM治疗方法,此前该药物已被证明可以为患有该疾病的成年人提供治疗益处。英国患者以前在临床上的治疗选择只能改善症状,而此次获批的米哚妥林则是一种可以抑制KIT信号传导、细胞增殖和组胺释放以及诱导肥大细胞凋亡的靶向治疗方法。
根据《新英格兰医学杂志》上的试验结果显示,米哚妥林可抑制推动肥大细胞增多症疾病进展的KIT D816V。试验数据显示,米哚妥林组患者的总体响应率为60%,其中45%的患者出现了至少一个肥大相关性器官损害的完全消退。米哚妥林组患者的中位总生存期为28.7个月,中位无进展生存期为14.1个月。安全性方面,56%米哚妥林组的患者因药物毒性而减小了剂量,但这些患者中32%可再次将剂量增加至试验开始时的水平。米哚妥林最常见的不良反应是低级别的恶心、呕吐和腹泻。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:患者需要了解雷德帕斯/米哚妥林(MIDOSTAURIN)的相关安全信息
更多药品详情请访问 米哚妥林 https://www.kangbixing.com/bxyw/mdtl/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问