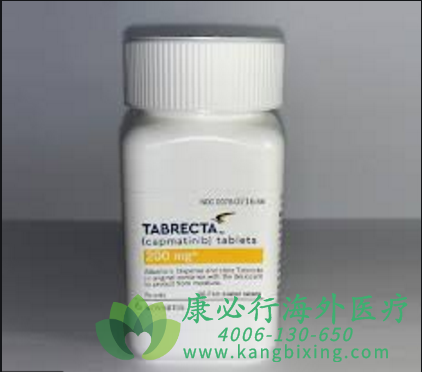
2020年5月6日,诺华(Novartis)公司宣布,美国食品药品监督管理局FDA已批准其MET抑制剂Tabrecta卡马替尼(capmatinib)上市,用于治疗携带异常的间质上皮转化(MET)基因外显子14跳跃突变的、已扩散转移且无法通过手术移除的非小细胞肺癌(NSCLC)患者。
临床研究案例,共纳入了97例MET基因外显子14跳跃突变且EGFR/ALK阴性的晚期NSCLC,接受卡马替尼400mg,每天两次,口服,直到病情进展或出现不可耐受的毒性反应。
入组患者的人群特征为:中位年龄为71岁;60%的患者为女性;75%的患者为白人;ECOG评分为0(24%)或1(75%);60%的患者无吸烟史;80%的患者为腺癌;12%的患者存在脑转移;69例经治患者中88%接受过含铂化疗。
研究数据表明:初治患者(n=28)VS经治患者(n=69)的客观缓解率(ORR)为68%VS 41%;完全缓解(CR)为4%VS 0%;部分缓解(PR)为64%VS 41%;中位持续反应时间(DoR)为12.6个月VS 9.7个月,持续缓解时间≥12个月的患者比例为47%VS 32%。
不良反应
最常见的不良反应有:手或脚肿胀;恶心;疲倦;呕吐;食欲不振;某些血液检查的变化。
说明书其他节更加详细讨论以下不良反应:间质性肺疾病(ILD)/肺炎;肝毒性;
警告和注意事项
间质性肺疾病(ILD)/肺炎:用卡马替尼治疗的患者发生了可能致命的ILD/肺炎。
若怀疑没有引起ILD/肺炎的其他潜在病因,请立即停止对疑似ILD/肺炎患者的卡马替尼治疗,并永久终止治疗。
肝毒性:在开始使用卡马替尼之前,应在治疗的前3个月中每2周监测一次肝功能检查(包括ALT,AST和总胆红素),然后每月一次或按临床指示进行监测,对发展中的患者进行更频繁的检查转氨酶或胆红素。
根据不良反应的严重程度,应停用,减少剂量或永久停用卡马替尼。
光敏性的风险:根据动物研究的结果,卡马替尼有光敏反应的潜在风险。在GEOMETRY mono-1中,建议患者在用卡马替尼治疗期间应采取预防紫外线照射的预防措施,例如使用防晒霜或穿防护服。建议患者在用卡马替尼治疗期间限制直接紫外线照射。
胚胎-胎儿毒性:根据动物研究的结果及其作用机理,卡马替尼对孕妇给药可引起胎儿的伤害。
建议孕妇注意胎儿的潜在危险。劝告有生殖潜力的女性及其伴侣在用卡马替尼治疗期间以及最后一次用药后1周内使用有效的避孕方法。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 卡马替尼 https://www.kangbixing.com/drug/kmtn/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问