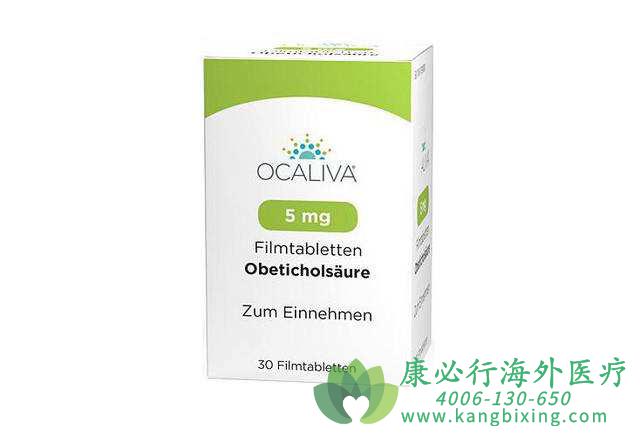
奥贝胆酸是一种获批用于治疗原发性胆汁胆管炎的口服药物,也是表达在肠与肝脏上的法尼醇X受体(FXR)的激动剂。FXR是胆酸、炎症反应、纤维化与代谢通路的关键调节分子。FXR的活化可以降低在肝细胞内胆酸的浓度,这是借着抑制自胆固醇生产胆酸,以及增加胆酸自肝细胞运出的结果。
奥贝胆酸(Ocaliva,obeticholic acid)在REGENERATE关键临床3期试验的新中期分析积极结果。这是检验奥贝胆酸在非酒精性脂肪性肝炎(NASH)引起的肝纤维化病患疗效的第二次数据分析,结果显示奥贝胆酸在意向性治疗(ITT)人群中达成试验主要终点
REGENERATE是一项全球性、多中心、随机、双盲、以安慰剂为对照组的临床3期试验,目的为检验奥贝胆酸在NASH肝纤维化患者身上的疗效与安全性。此试验总共有2480位病患入组。这次新的中期分析总共包含了931位病患,这些病患在试验第18个月进行预定的肝组织活检,并与之在基线的肝组织活检结果相比较。此次中期分析的病患群体组成与2019年的病患群体类似,但在组织阅片分析时是根据最近美国FDA修改的指导。
ITT人群中的中期分析结果显示,在随机分配每天服用1次25毫克奥贝胆酸的病患中,有22.4%达到试验主要终点,亦即在第18个月时,其纤维化程度至少改善一个阶段且NASH情况没有恶化。与此同时,只有9.6%的安慰剂组病患达成这一指标(p<0.0001)。此结果与原先在2019年所公布的分析积极结果一致,原分析亦显示25毫克的奥贝胆酸可以在统计上显著地改善纤维化情形(p=0.0002)。
安全性分析包含了2477位至少服用了一剂药物(安慰剂、10毫克奥贝胆酸或25毫克奥贝胆酸)的患者。与之前的分析相较,包含在此次中期分析的病患有显著较长暴露在药品的时间(中位时间42个月vs.15个月),其中将近1000位病患服用试验药物达4年。治疗伴发不良反应(TEAE)、治疗伴发严重不良反应(TESAE)与死亡情形,大致上平均出现于奥贝胆酸治疗组与安慰剂组。最常见的治疗伴发不良反应为瘙痒(安慰剂组24%,10毫克奥贝胆酸组33%,25毫克奥贝胆酸组55%),而瘙痒也成为停止治疗最常见的原因。在所有组别中产生胆囊相关反应的比率小于3%,这与药物的已知机制相关。在25毫克奥贝胆酸组有较高比率产生包含胆石在内的胆汁相关事件。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 奥贝胆酸 https://www.kangbixing.com/fsmy/OCALIVA/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问