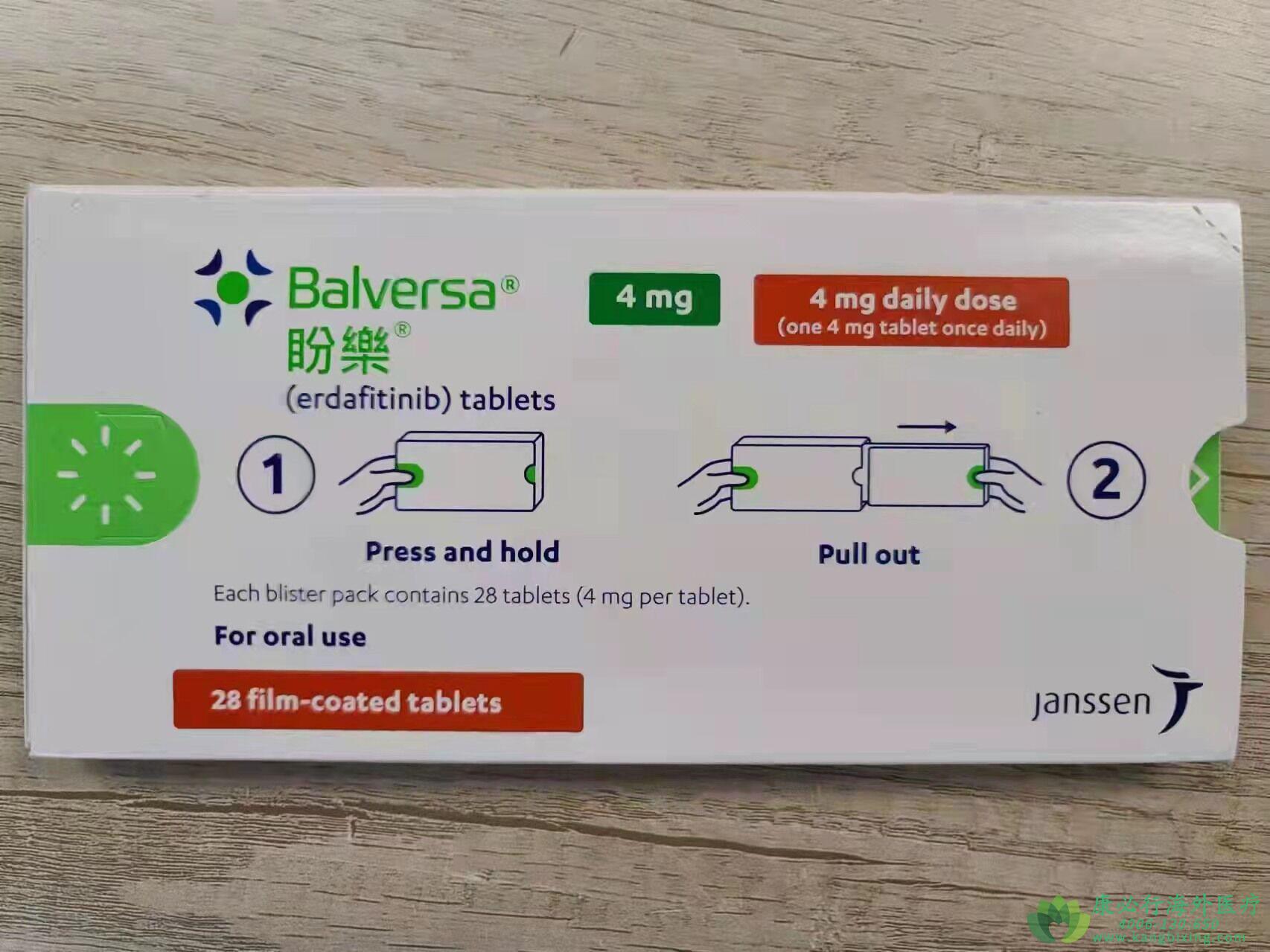
厄达替尼(BALVERSA/ERDAFITINIB)是一种口服泛FGFR抑制剂。FGFRs是一个受体酪氨酸激酶家族,在不同肿瘤中出现的基因突变可以导致它们被激活,从而促进肿瘤细胞的生存和增殖。Erdafitinib曾经获得FDA授予膀胱癌的突破性疗法认定,该药物的新药申请也获得了优先审评资格。FDA药物评估和研究中心血液学和肿瘤学产品办公室主任理查德·帕兹德说:“我们正处于一个更加个性化的精准医学时代。Balversa代表了第一个针对FGFR遗传变异的转移性膀胱癌患者的治疗方案”。美国FDA加速批准了厄达替尼Balversa(erdafitinib)用于在铂类化疗期间或化疗后出现疾病进展的局部晚期或转移性尿路上皮癌,患者具有FGFR3或FGFR2基因突变,包括新辅助或辅助铂类化疗12个月内的患者。这是FDA准予的首款针对转移性膀胱癌的靶向疗法。
厄达替尼Balversa(erdafitinib)的获批是基于一项多中心、开放性单臂试验BLC2001(NCT02365597)数据,BLC2001研究是一项多中心、开放标签、单臂二期临床试验,87例尿路上皮癌患者可供评估,中位年龄67岁,79%男性,74%白人,92%PS评分为0-1,66%的患者有转移病灶。97%患者均接受过至少1次含铂化疗,3例患者仅接受过新辅助化疗或辅助化疗。24%的患者接受过PD-1/L1免疫治疗。完全缓解率2.3%,部分缓解率29.9%,总有效率32.2%,中位有效持续时间5.4月。入组患者均携带至少一种FGFR2/3突变或融合,如FGFR3突变(R248C,S249C,G370C和Y373C),FGFR2融合(FGFR2-BICC1和FGFR2-CASP7)和FGFR3融合(FGFR3-TACC3和FGFR3-BAIAP2L1)。对于FGFR3突变(n=64),总有效率为40.6%;对于FGFR3融合(n=18),总有效率为11.1%;对于FGFR2融合(n=6),总有效率为0%。
41%的患者发生严重不良反应,1例患者死于急性心肌梗塞。13%的患者因不良反应永久停用厄达替尼,最常见的原因是眼部疾病(6%)。68%的患者因不良反应暂停厄达替尼,最常见的原因是高磷血症(24%)、口腔炎(15%)、眼部疾病(17%)和手足综合症(8%)。53%的患者因不良反应减量厄达替尼,最常见的原因是眼部疾病(23%)、口腔炎(15%)、高磷血症(7%)、手足综合症(7%)、甲沟炎(7%)和指甲失养症(6%)。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 厄达替尼 https://www.kangbixing.com/drug/edatini/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问