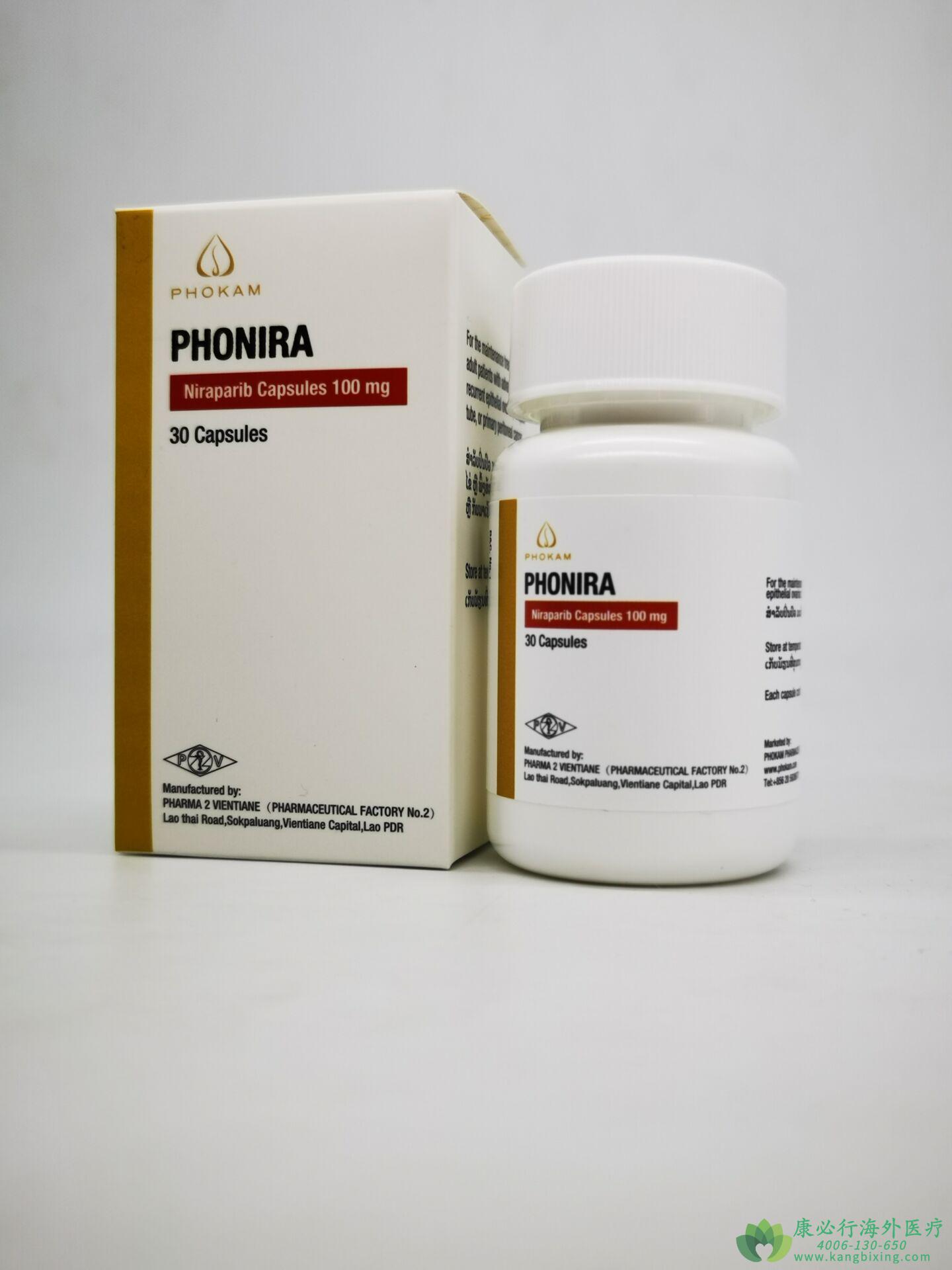
欧盟委员会已批准将尼拉帕利(Zejula)用作一线单一疗法维持治疗方案,用于以铂为基础的成年晚期上皮癌,高级卵巢癌,输卵管癌或原发性腹膜癌的成年患者,这些患者会完全或部分缓解(PR)化学疗法。
在双盲,随机,安慰剂对照的3期PRIMA试验中,将733例患者按2:1的比例随机接受PARP抑制剂(n=487)或安慰剂(n=246)。参与者在接受最后一轮化疗后的12周内接受了随机分组。在研究开始时,尼拉帕利的固定剂量为300 mg。对于体重不足77千克或血小板计数低于150 L/μL的患者,尼拉帕利剂量应降至200 mg。该试验的中位相对剂量强度为63%。在28天的周期中每天连续进行一次治疗。
该试验中约70%的患者的ECOG表现状态为1。三分之一的患者患有IV期疾病,而三分之二的患者处于FIGO III期。主要的肿瘤部位是卵巢,输卵管和腹膜。约95%的参与者患有浆液性组织学,三分之二接受了新辅助化疗。没有参与者接受贝伐单抗(Avastin)的治疗,因为该试验是在药物批准用于一线治疗之前设计的。该试验的主要终点是每次独立盲人独立委员会审查均得出PFS,次要终点包括总体生存期(OS)和患者报告的结局(PRO)。分层的依据是患者是否接受新辅助化疗,如果他们对一线治疗的最佳反应导致完全反应(CR)或PR,HRD状态以及每位患者使用的辅助诊断。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 尼拉帕利 https://www.kangbixing.com/bxyw/nlpn/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问