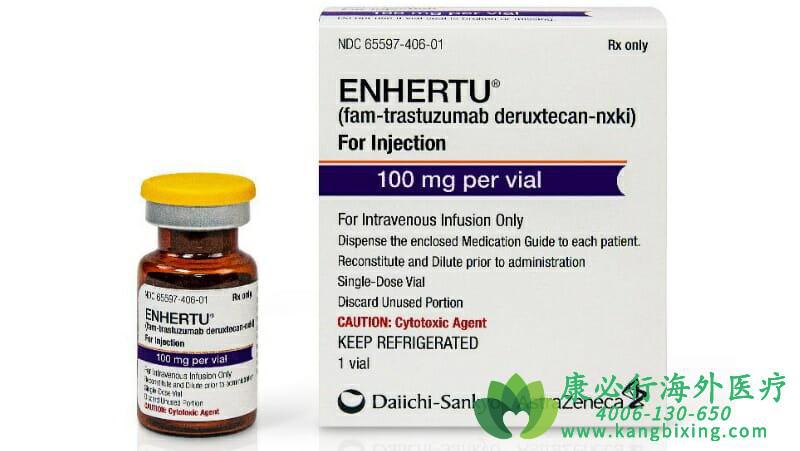
2019年12月21日,基于DESTINY-Breast01研究,FDA正式批准Enhertu用于HER2阳性乳腺癌的后线治疗。2020年5月18日,阿斯利康和第一三共联合宣布,双方共同开发的靶向HER2的抗体偶联药物(ADC)Enhertu获得美国FDA授予的突破性疗法(BTD)认定,用于治疗HER2突变的铂类治疗中或治疗后疾病进展的转移性非小细胞肺癌(NSCLC)患者。
Enhertu是一类ADC型药物,由抗HER2的IgG1单抗通过连接体,与拓扑异构酶Ⅰ抑制剂Dxd(效能比伊立替康高10倍)组成,既可靶向结合抑制,也可裂解化学抗癌。相比国内上市的ADC型药物T-DM1(HER2抗体+微管抑制剂),具有高细胞膜穿透性、高携带性优势。
基于DESTINY-Breast04的结果,FDA批准Enhertu用于治疗无法切除或转移性HER2低表达乳腺癌患者。这是首个获批用于HER2低表达乳腺癌亚型患者的疗法,该亚型是新定义的HER2阴性乳腺癌亚型。DESTINY-Breast04共入组HER2低表达晚期乳腺癌化疗失败患者557例,按2∶1的比例随机分为两组:Enhertu(5.4mg/kg)组373例、医生选择化疗(TPC)组184例,其中HR+494例(88.7%,Enhertu组331例、TPC组163例)、HR-63例(11.3%)。
主要终点为HR+患者的无进展生存(PFS)。关键次要终点为全部患者(FAS;HR+/?)的PFS、HR+患者和全部患者的总生存(OS)。中位随访时间为18.4个月(95%CI:17.9-19.1)。在HR+队列中,与TPC相比,Enhertu将患者疾病进展或死亡风险降低49%(HR=0.51,95%CI:0.40-0.64;P<0.001),Enhertu组和TPC组的中位PFS分别为10.1个月和5.4个月。Enhertu还将死亡风险降低了36%(HR=0.64,95%CI:0.48-0.86;P=0.003),两组的中位OS分别为23.9个月和17.5个月。在全体患者中,与TPC相比,Enhertu将患者疾病进展或死亡风险降低50%(HR=0.50,95%CI:0.40-0.63;P<0.001),Enhertu组和TPC组的中位PFS分别为9.9个月和5.1个月。Enhertu还将死亡风险降低了36%(HR=0.64,95%CI:0.49-0.84;P=0.001),两组的中位OS分别为23.4个月和16.8个月。
对不同患者亚群的探索性分析显示,无论患者是否曾经接受过CDK4/6抑制剂的治疗,或此前接受过化疗种类的多少,Enhertu都显示出一致的疗效。DESTINY-Breast04结果显示,与标准治疗相比,无论HR状态如何,患者的PFS和OS均有统计学显着和临床意义显着的获益,且总体安全可控。DESTINY-Breast04是第一个针对HER2低表达患者并获得阳性结果的III期临床试验,这一里程碑式的突破意味着Enhertu或将为过半数乳腺癌患者带来全新治疗模式!
近日,JCO发表一篇Enhertu治疗HER2低表达低胃或胃食管结合部癌的II期试验的探索性队列结果。局部晚期或转移性HER2低表达胃或胃食管结合部癌(队列1,免疫组织化学2+/原位杂交阴性;队列2,免疫组织化学1+),患者接受过至少两种既往治疗方案,包括氟嘧啶和铂类,但未接受抗HER2治疗,所有每3周静脉注射一次Enhertu6.4mg/kg。主要终点是客观反应率。
结果显示,队列和队列2分别有19名和21名入组。队列1中有5个部分缓解(PR),队列2中有两个,确认客观缓解率(ORR)为26.3%(95%CI,9.1-51.2)和9.5%(95%CI,1.2-30.4)。队列1中13名患者(68.4%),队列2中的12人(60.0%)肿瘤缩小。队列1的中位总生存期(OS)为7.8个月(95%CI,4.7-不可评估),队列2为8.5个月(95%CI,4.3-10.9);中位无进展生存期(PFS)分别为4.4个月(95%CI,2.7至7.1)和2.8个月(95%CI,1.5至4.3)。队列1和队列2中最常见的≥3级治疗突发不良事件是贫血(30.0%和29.2%),中性粒细胞计数减少(25.0%和29.2%),食欲下降(20.0%和20.8%)。每个队列中有一名患者发生药物相关间质性肺病/肺炎(1级或2级)。没有发生与药物有关的死亡。
HERB试验是一项由研究者发起的、多中心、单臂的Enhertu治疗HER2表达BTC患者的II期临床试验。研究纳入32例胆道癌患者,其中HER2阳性24例,HER2低表达BTC患者8例。22例HER2阳性患者中,IHC3+和IHC2+/ISH+患者比例分别为45.5%和54.5%,原发部位胆囊/肝外/肝内/壶腹为11/6/3/2,既往方案中位数为2个。研究受试者均为难治性或不能耐受标准治疗,受试者每3周接受5.4mg/kgEnhertu治疗,在开始治疗的24周内每6周进行一次肿瘤CT或MRI检查,随后每12周进行一次,并应用RECIST1.1进行评估。
研究结果显示,在22例可评估的HER2阳性患者中,ORR为36.4%,其中2例完全缓解(CR),6例部分缓解(PR),ORR改善有统计学意义(P=0.01)。DCR为81.8%(95%CI59.7-94.8)、中位PFS为4.4个月(95%CI2.8-8.3)、mOS为7.1个月(95%CI4.7-14.6)。在HER2低表达的患者中也能看到令人鼓舞的疗效:ORR、DCR分别为12.5%(95%CI0.3,52.7)、75.0%(95%CI,34.996.8);mPFS和mOS分别为4.2个月(95%CI,1.36.2)和8.9个月(95%CI,3.012.8)。
在安全性分析中,≥3级的不良反应发生率为81.3%,常见的为贫血(53.1%)、中性粒细胞减少(31.3%)、白细胞减少(31.3%)。值得注意的是,8例(25.0%)患者发生间质性肺疾病的不良事件,其中2例为5级致命事件。
总的来说,Enhertu在HER2表达的BTC患者中显示出良好的活性。目前,一项大型多中心开放标签Ⅱ期全球试验正在进行中,以进一步评估Enhertu在HER2阳性肿瘤(包括胆道癌)中的疗效(NCT04482309)。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:ENHERTU/DS-8201已被批准治疗HER2-低表达乳腺癌?
更多药品详情请访问 Enhertu https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问