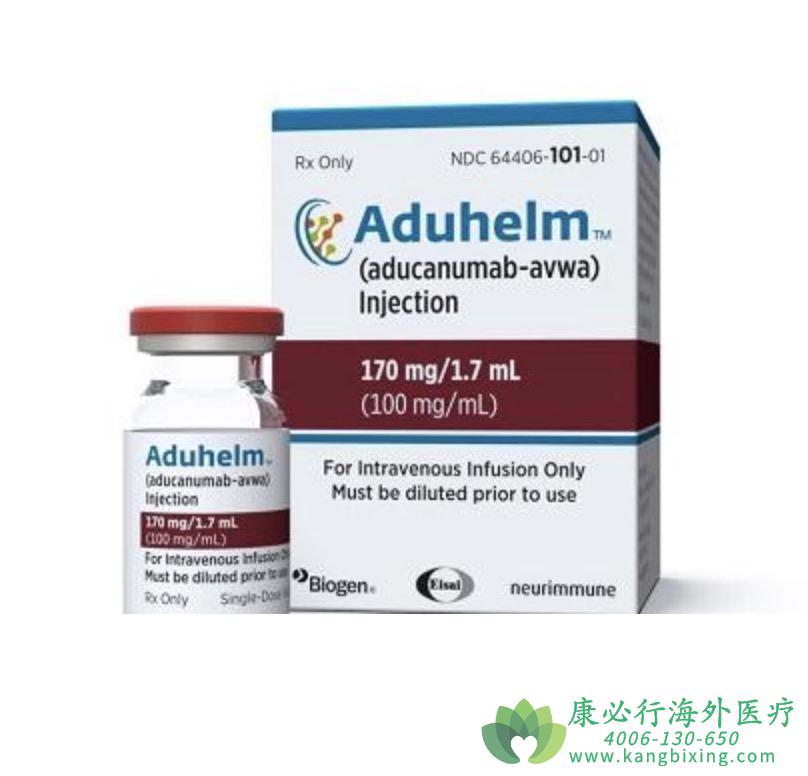
阿尔茨海默症(AD)是一种神经系统退行性疾病,临床上以记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆表现为特征,病因迄今未明。2021年6月7日,百健(Biogen)和卫材研发的Aduhelm获FDA批准,成为近20年来美国首个获批的阿尔茨海默症治疗药物,也是首款FDA批准的靶向AD潜在疾病机理的新疗法。Aduhelm采用加速批准途径在FDA获批。加速批准途径用于治疗严重或危及生命的疾病的药物,并且这类药物与现有治疗方法相比可以提供有意义的治疗优势。
Aduhelm的疗效在两项III期临床试验EMERGE和ENGAGE中进行验证。EMERGE研究中,1638例患者随机1:1:1接受Aduhelm低剂量、高剂量或安慰剂治疗,Aduhelm高剂量组可减少临床衰退,与安慰剂相比,Aduhelm高剂量组治疗效果显著。ENGAGE研究中,1647例患者按1:1:1的比例随机接受Aduhelm低剂量、高剂量或安慰剂治疗,第78周评估时,Aduhelm治疗组和安慰剂治疗组之间没有观察到统计学上的显著差异。EMERGE研究结果显示,在该种药物的作用下,临床上的认知衰退会减少;ENGAGE研究结果显示认知衰退没有减少。EMERGE试验中,高剂量的药物仅略微减缓了认知能力的下降,在18个月的时间里大约延缓了4个月。
Aduhelm每月静脉输注一次,患者需要定期进行MRI扫描,因为试验中有40%的患者出现脑肿胀或出血,其中许多是轻度或无症状的。有专家估计,每200-300名患者中就有1人会有严重的副作用,需要住院治疗。FDA目前还没有列出Aduhelm使用中的禁忌症,但专家建议,如果患者有脑出血、中风或病情不稳定的病史,或者正在服用血液稀释剂,则应避免服用该药物。因为临床研究对象是轻度阿尔茨海默症和高淀粉样蛋白的患者,所以治疗对象还是应集中在轻度患者。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 Aduhelm https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问