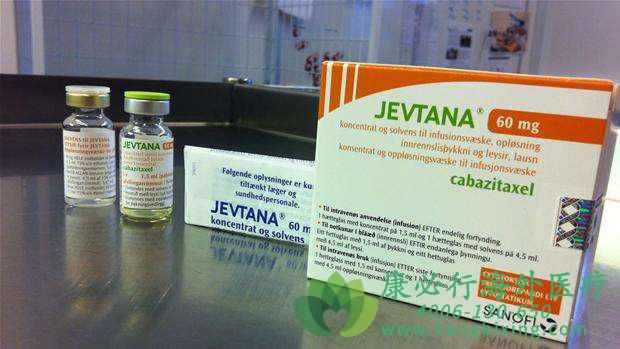
卡巴他赛(cabazitaxel)是一类新的紫杉烷类衍生物,因其能够克服紫杉醇的耐药性以及临床上表现出较好的疗效,于2010年6月经美国FDA批准上市用于治疗激素抵抗的转移性前列腺癌。但是该药物的水溶性差,需要通过添加表面活性剂(如吐温80)并配合13%的乙醇水溶液来助溶,由此在体内会导致一定的过敏反应及其他生理毒性。
法国波尔多大学研究人员报告,FUJI队列中应用卡巴他赛治疗的真实生存期短于关键性研究TROPIC或PROSELICA。几线应用并不影响生存期,未见超预期的不良事件。
多西他赛治疗转移性去势抵抗性前列腺癌(mCRPC)失败后,卡巴他赛是一种治疗选择。为了明确卡巴他赛在真实世界中的总生存期(OS)、无进展生存期(PFS)及安全性,多中心、非干预性法国研究(FUJI队列)入组启用卡巴他赛治疗的mCRPC患者,随访18个月。
结果显示,42个中心招募了401例患者,中位年龄为70岁,主要转移部位为骨骼(87%)、淋巴结(42%)和内脏(20%)。卡巴他赛的二线治疗应用率为18%,三线为39%,四线及以上为43%。既往多西他赛应用率为100%,既往阿比特龙、恩杂鲁胺或两者兼用者占82%。卡巴他赛治疗的中位时间为3.4个月。
卡巴他赛治疗后的中位OS为11.9个月(95%CI 10.1~12.9个月)。在多变量分析中,≥3级不良事件、内脏转移、多药治疗和>5个骨转移均与较短的OS相关。≥3级主要不良事件为血液学毒性,其中发热中性粒细胞减少发生率为8%。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 卡巴他赛 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问