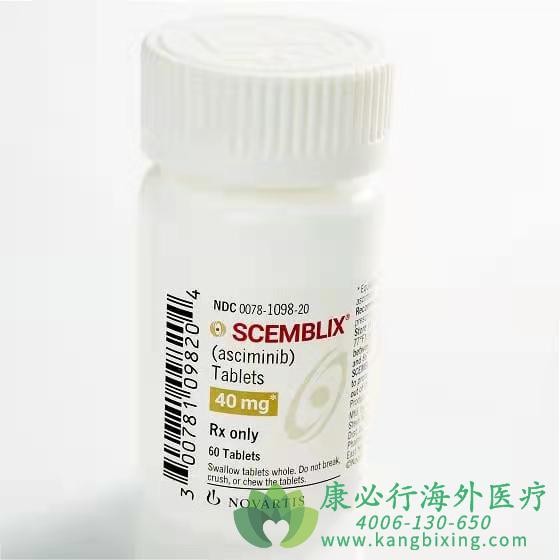
美国食品和药品监督管理局(FDA)批准Scemblix(asciminib)用于治疗慢性粒细胞白血病(CML)。根据24周时的主要分子反应(MMR)率,FDA加速批准Scemblix用于既往接受过两种或多种酪氨酸激酶抑制剂(TKI)治疗的费城染色体阳性CML慢性期(Ph+CML-CP)成人患者,并批准用于具有T315I突变的Ph+CML-CP成人患者。Scemblix也被称为STAMP抑制剂,正在针对CML-CP的多个治疗线进行研究,包括评估Scemblix作为一线治疗的ASC4FIRSTIII期研究。
对于许多患者来说,当前的CML治疗可能会受到不耐受或耐药性的限制,并且连续使用可用的TKI与失败率增加有关。在对接受过两种先前TKI治疗的CML患者的分析中,大约55%的患者报告对先前的治疗不耐受。此外,在二线环境中的汇总分析显示,高达70%的患者在随访的两年内无法达到主要分子反应(MMR)。此外,发生T315I突变的患者对大多数可用的TKI具有抗性,使他们的疾病进展风险增加。
Scemblix为慢性粒细胞白血病(CML)患者提供了急需且期待已久的新选择,这些患者在之前至少接受过两种酪氨酸激酶抑制剂(TKI)治疗后出现不耐受或反应不足。在关键的III期ASCEMBL试验中,Scemblix在24周时与Bosulif(博舒替尼)(25%对13%)相比,在主要分子反应(MMR)率方面表现出显著且具有临床意义的优势,并且由于副作用而导致的停药率较低(7%对25%)。
纪念斯隆凯特琳癌症中心的血液学家和骨髓增殖性肿瘤项目负责人MichaelJ.Mauro博士表示:“当目前可用的治疗方法使患者失败、治疗副作用无法耐受,或有时两者兼有时,CML可能难以治疗。将Scemblix添加到CML治疗领域为我们提供了一种对抗这种血癌的新方法”。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 Scemblix https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问