2021年5月28日,BridgeBio Pharma的子公司QED Therapeutics和合作伙伴Helsinn集团宣布,美国FDA已加速批准Truseltiq(英菲格拉替尼)用于治疗携带FGFR2融合或重排的局部晚期或转移性胆管癌(CCA)经治患者。
英菲格拉替尼是一种口服、ATP竞争性、FGFR1-3酪氨酸激酶抑制剂,目前正在研究用于肿瘤中存在FGFR突变的患者,包括胆管癌、尿路上皮癌和软骨发育不全。在晚期、不可切除CCA患者的关键性临床试验中,英菲格拉替尼可导致肿瘤缩小。
QED Therapeutics公司首席医疗官Susan Moran博士在接受采访时表示:对于那些经一线治疗后复发、需要进一步治疗的FGFR2融合CCA患者来说,这是一个重要的里程碑。基于目前所看到的疗效,英菲格拉替尼有望用于一系列FGFR驱动的肿瘤。我们将继续评估英菲格拉替尼在这些需求未得到满足领域的安全性和有效性。
该批准是基于一项单臂II期临床研究 (NCT02150967),计划招募大约160名患者,由 3 个队列组成:携带FGFR2基因融合/重排的队列(队列1;n = 120)、携带FGFR1&3基因融合/重排和/或 FGFR 突变的队列(队列 2;n =20)和携带FGFR2基因融合、先前用选择性FGFR抑制剂(非英菲格拉替尼)治疗后进展的队列(队列 3;n = 20)。本次分析主要侧重于队列1:携带FGFR2基因融合或重排但未接受过FGFR抑制剂治疗的患者。
截止2020年3月31日,108例既往接受过至少一种先前治疗的晚期CCA患者中,107例(99%)为IV期CCA,83例(77%)携带FGFR2融合,中位年龄为53岁(范围,23-81),62.0%为女性,72.2%为白人,57.4%的ECOG(美国东部肿瘤协作组)体能状态为1。此外,患者接受了中位数为2的先前治疗,46.3%接受了0或1个先前的治疗,29.6%接受了2个先前的治疗,13.0%接受了3个先前的治疗,11.1%接受了4个或更多的先前治疗。
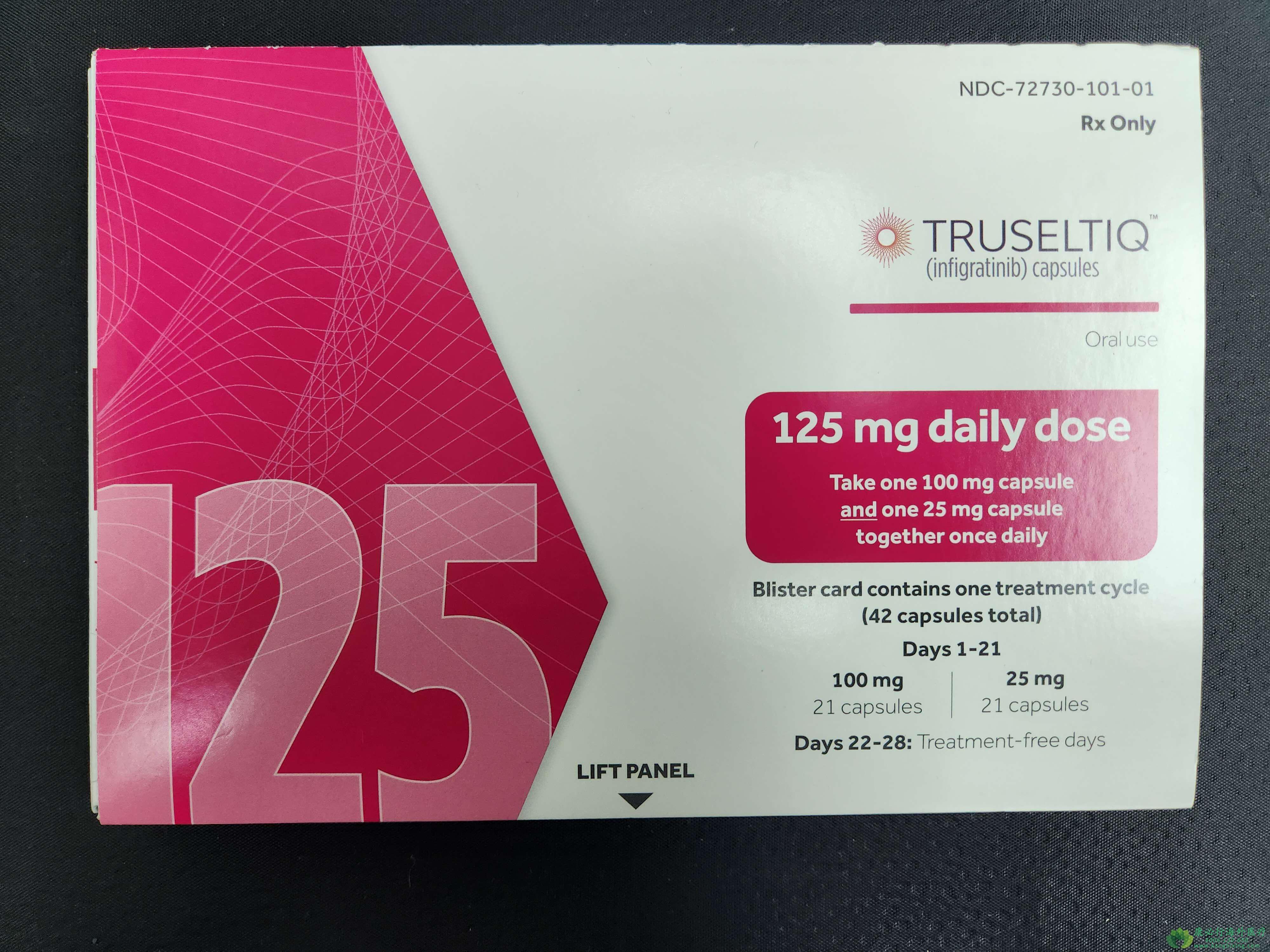
患者在每28天的治疗周期中给予单药英菲格拉替尼,剂量为125mg,每日一次,共21天,直到发生不可接受的毒性或疾病进展。该试验的主要研究终点为确认的客观缓解率(ORR)和 反应持续时间(DOR),次要终点包括无进展生存期 (PFS)、疾病控制率 (DCR)、最佳ORR、总生存期(OS)、安全性和药代动力学。中位随访时间10.6个月(范围,1.1-55.9个月),96 名患者(88.9%)停止治疗(12名正在进行)。患者确认的ORR为23.1%(95% CI,16-32%),包括1例达到完全缓解(CR)和24例达到部分缓解(PR),中位DOR为5.0个月(95% CI,3.7-9.3个月)。在25例有反应的患者中,8 例(32.0%)患者的 DOR ≥ 6 个月。
亚组分析显示,在接受过0到1次先前治疗的患者中(n = 50),确认ORR为34.0%(95% CI,21.2 %-48.8%),最佳ORR为42.0%(95% CI,28.2%-56.8%),DCR为88.0%(95% CI,75.7%-95.5%)。在接受过2线或更多线治疗的患者中,确认ORR为13.8%(95% CI,6.1%-25.4%),最佳ORR为27.6%(95% CI,16.7%-40.9%),DCR为81.0%(95% CI,68.6%-90.1%)。
英菲格拉替尼常见的不良反应包括肌酐增加、磷酸盐增加、磷酸盐减少、指甲毒性、口腔炎、碱性磷酸酶增加、血红蛋白减少、丙氨酸转氨酶增加、干眼症、疲劳、脂肪酶增加、淋巴细胞减少、钙增加、钠减少、脱发、甘油三酯增加、天冬氨酸转氨酶增加、血小板减少、尿酸盐增加、掌跖红肿综合征、关节痛和味觉障碍。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:英菲格拉替尼(INFIGRATINIB/TRUSELTIQ)针对晚期实体瘤安全有效?
更多药品详情请访问 英菲格拉替尼 https://www.kangbixing.com/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问












