司帕生坦 PROTECT是一项国际性、随机、双盲、主动对照研究,在18个国家的134个临床实践点进行。该研究对司帕生坦 与厄贝沙坦在活检证实的IgA肾病和最大耐受剂量肾素-血管紧张素系统抑制剂治疗至少12周蛋白尿仍≥1.0 g/天的成人(年龄≥18岁)进行对比。参与者按1:1的比例随机分配,接受司帕生坦400 mg/天一次或厄贝沙坦300 mg/天一次,根据筛查时估计的肾小球滤过率(30至<60 mL/min/1.73 m2和≥60 mL/min/1.73 m2)和筛查时尿蛋白排泄量(≤1.75 g/天和>1.75 g/天)分层。主要疗效终点:(24小时)尿蛋白肌酐比基线至第36周变化,混合模型重复检测评估。安全性终点为治疗发生不良事件(TEAE)。至少一个剂量随机治疗的研究对象检查所有终点。该研究正在进行中,并已在ClinicalTrials.gov注册(NCT03762850)。
基于蛋白尿的减少,该适应症在加速批准下获得批准。尚未确定FILSPARI是否能减缓IgAN患者的肾功能下降。FILSPARI的持续批准可能取决于正在进行的3期PROTECT研究中临床益处的确认,该研究旨在证明FILSPARI是否能减缓肾功能下降。Travere预计PROTECT研究中两年确认终点的顶线结果将在2023年第四季度公布,旨在支持FILSPARI的传统批准。
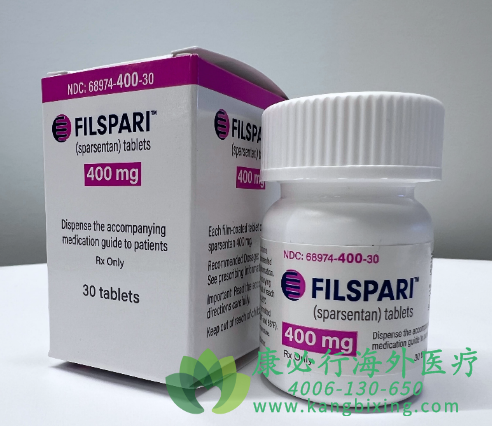
FILSPARI司帕生坦 的批准是根据FDA的加速批准途径授予的,其基础是与正在进行的关键和正在进行的第3期PROTECT研究中的活性比较药物相比,蛋白尿具有临床意义和统计学意义的改善,这是迄今为止最大的头对头干预研究在IgAN中。PROTECT研究是一项全球性、随机、多中心、双盲、主动对照临床试验,评估400毫克FILSPARI与300毫克厄贝沙坦相比在404名18岁及以上IgAN和顽固性IgAN患者中的安全性和有效性尽管接受了最大耐受的ACE或ARB治疗,仍出现蛋白尿。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 司帕生坦 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问