在美国开展了一项ARROW的一期/二期开放标签、非随机、多中心的临床试验。此项临床试验共招募114名患者,其中一组为87名转移性RET融合阳性非小细胞肺癌患者,其癌症在铂类化疗后进展,而另一个组为27名先前未治疗的转移性非小细胞肺癌患者。
该研究的主要目标是总体缓解率(ORR)和缓解持续时间(DOR)。
受试患者每天一次接受400毫克普拉替尼,直到疾病进展或出现不可接受的毒性。第一组87名先前接受过治疗的非小细胞肺癌患者的总体缓解率达到了57%。5.7%的患者表现出完全反应,52%的患者表现出对治疗的部分反应。总共80%的患者表现出了六个月或更长的缓解持续时间。
在先前未治疗的转移性非小细胞肺癌患者组,总体缓解率为70%。11%的患者表现出完全反应,59%的患者表现出对治疗的部分反应。中位缓解持续时间为9个月。58%的患者显示出的缓解持续时间至少为6个月。
普拉替尼在患者中观察到的常见副作用包括便秘、肌肉疼痛疲劳、高血压、中性粒细胞和淋巴细胞减少、血红蛋白减少、磷酸盐减少、钙减少、钠减少和丙氨酸氨基转移酶(ALT)增加。
正因为以上显著的临床试验数据,美国FDA加速批准普拉替尼上市,用于治疗RET融合阳性非小细胞肺癌(NSCLC)成人患者。
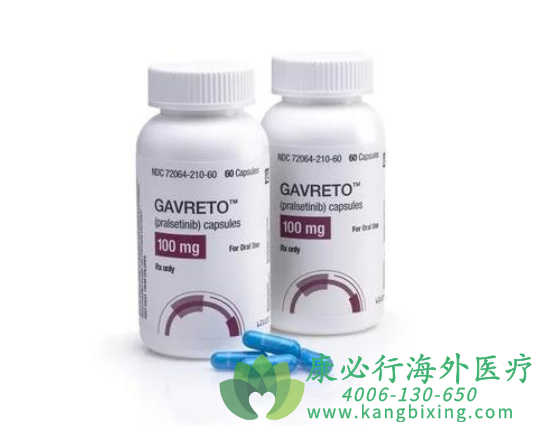
普拉替尼(普吉华)适应症
用于治疗RET融合阳性非小细胞肺癌(NSCLC)成人患者、12岁以上需要全身治疗的晚期或转移性RET突变甲状腺髓样癌(MTC)患者和需要全身治疗且放射性碘难治性晚期或转移性RET融合阳性甲状腺癌患者。
普拉替尼(普吉华)获批历史
美国食品药品监督管理局(FDA)于2020年5月批准其用于治疗RET融合阳性的非小细胞肺癌成人患者。
FDA于2个月后,2020年7月批准普拉替尼用于治疗晚期RET突变甲状腺髓样癌(MTC)和RET融合阳性甲状腺癌。
2021年11月20日,欧盟委员会(EC)批准普拉替尼作为一种单药疗法,用于治疗先前没有接受过RET抑制剂治疗的RET融合阳性晚期非小细胞肺癌(NSCLC)成人患者。这是欧盟首个一线治疗RET融合阳性晚期NSCLC的精准疗法。
普拉替尼(普吉华)于2021年3月23日获批在中国上市,但是至今未纳入医保范围,患者全额自费,经济负担很重。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 普拉替尼 https://www.kangbixing.com/drug/plxtn/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问