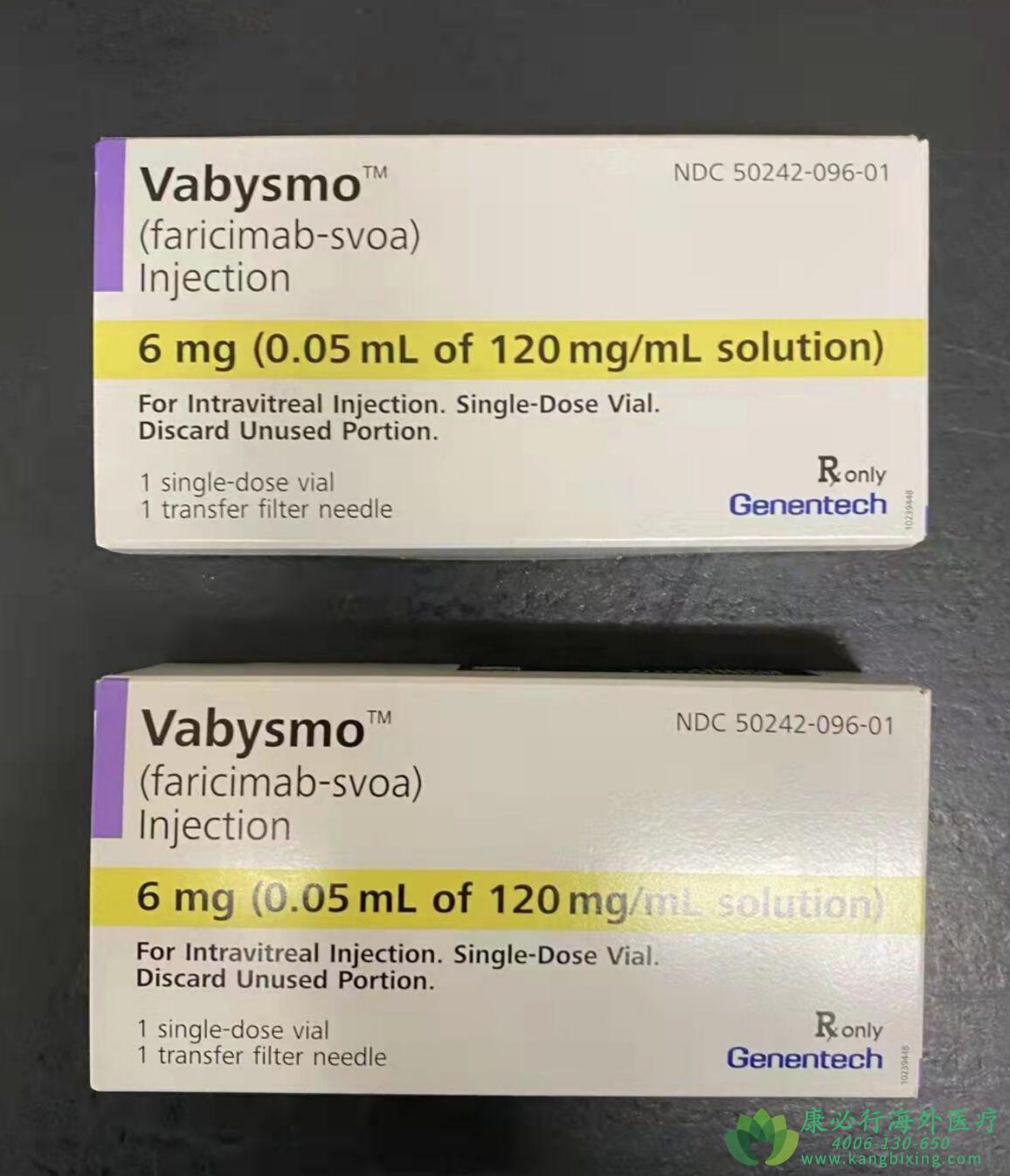
Vabysmo是一种双特异性单克隆抗体,通过中和血管生成素-2(Ang-2)和血管内皮生长因子-A(VEGF-A)两种通路,靶向和抑制这两种通路导致的许多威胁视力的视网膜疾病。2022年1月28日,基因泰克(Genentech)公司宣布美国食品药品监督管理局(FDA)已批准使用Vabysmo(faricimab-svoa)治疗湿性或新生血管性年龄相关性黄斑变性(AMD)和糖尿病性黄斑水肿(DME)。值得一提的是,Vabysmo是第一种也是唯一1种经FDA批准的用于湿性年龄相关性黄斑变性和糖尿病性黄斑水肿的可注射眼用药物。
该批准是基于两项针对湿性年龄相关性黄斑变性患者的3期试验(TENAYA[临床试验标识码:NCT03823287]和LUCERNE[临床试验标识码:NCT03823300])和两项针对糖尿病性黄斑水肿患者的3期试验(YOSEMITE[临床试验标识码:NCT03622580]和RHINE[临床试验标识码:NCT03622593])的数据。
这些试验的结果表明,与aflibercept相比,每隔最长4个月接受Vabysmo治疗的患者获得了非劣效视力增益。Vabysmo最常见的不良反应是结膜出血。
安全性方面,各个研究组的安全性结果一致,没有视网膜血管炎或视网膜闭塞事件的报告。
Vabysmo禁用于患有活动性眼内炎症的患者以及患有眼部或眼周感染的患者。该产品通过玻璃体内注射给药,这与眼内炎和视网膜脱离、眼内压升高和血栓栓塞事件有关。
Vabysmo作为单剂量药瓶提供,内含120mg/mL的faricimab-svoa溶液,供玻璃体内使用。每个药瓶只能用于治疗一只眼睛。
在美国,湿性年龄相关性黄斑变性和糖尿病性黄斑水肿是成年人视力丧失的两个主要原因。Vabysmo靶向并抑制导致这两种黄斑疾病的两种疾病途径。这是一种可注射眼用药物,可根据患者需求灵活给药。
用药方面,在最初每月给药四次后的第一年,通过间隔1至4个月的治疗改善和维持视力。湿性年龄相关性黄斑变性和糖尿病性黄斑水肿的护理标准通常要求每一到两个月进行一次眼部注射。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 Vabysmo https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问












