诺和诺德公司(Novo Nordisk)宣布其口服司马鲁肽获得欧盟委员会(EC)的上市许可,作为饮食和运动辅助手段用以改善II型糖尿病成人患者的血糖控制。该上市许可适用于所有27个欧盟成员国和英国。目前,司马鲁肽已在美国、瑞士和欧盟获批。
司马鲁肽是全球第一个也是目前唯一的口服GLP-1受体激动剂,是令人瞩目的突破性药物。此次获批是基于10 PIONEER临床结果:在与西格列汀(DPP-4抑制剂)、恩格列净(SGLT2抑制剂)和利拉鲁肽(GLP-1受体激动剂)的头对头对照试验中,司马鲁肽被证明52周后的糖化血红蛋白(HbA1c)显著降低,体重减轻达4.3kg.在所有PIONEER临床中,司马鲁肽显示了安全性和良好的耐受性,常见的不良反应为轻度至中度恶心,但随着时间的推移逐渐减轻。司马鲁肽(口服semaglutide)是天然激素GLP-1的类似物,2019-09-20率先在美国获批。该药每天服用一次,有三个规格:3mg,7mg和14mg.
诺和诺德公司日前在内分泌学会年会(Endocrine Society Annual Meeting)上公布了该公司的口服司马鲁肽(semaglutide)在名为PIONEER 3的3a期临床试验中的疗效和长期安全性结果。这项研究同时发表在《JAMA》杂志上。试验结果表明,剂量为7 mg和14 mg的口服司马鲁肽与活性对照相比,在降低糖化血红蛋白(HbA1c)和体重方面表现出更好的疗效。
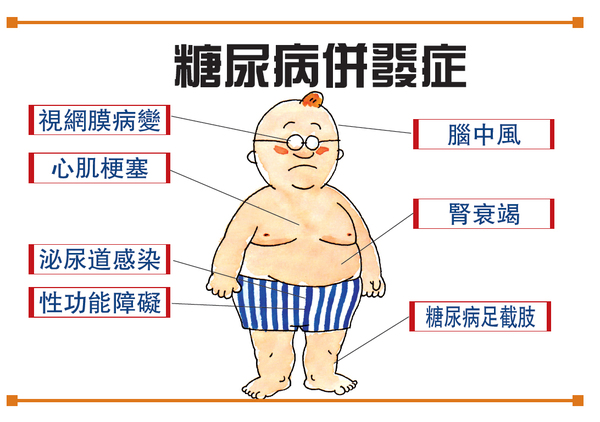
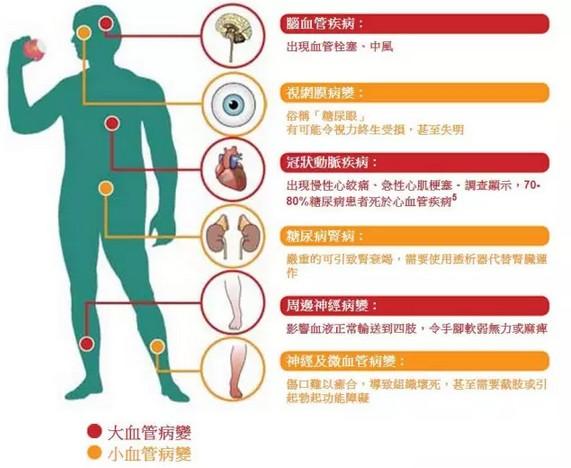
2型糖尿病的发生是由于胰岛素抗性提高和胰岛素分泌不足,可能对肾脏、心脏等重要器官的产生长期损害。司马鲁肽为胰高血糖样肽-1(GLP-1)类似物,是一种诱导胰岛素分泌的激素。每周一次的注射剂型已在2017年获得FDA批准治疗2型糖尿病。为提高疗法依从性和获得更好长期效果,诺和诺德公司继而开发了司马鲁肽的口服剂型。
在这项随机双盲,含安慰剂对照的多中心3期临床试验中,总计1864名2型糖尿病患者接受了不同剂量的口服司马鲁肽或者sitagliptin的治疗。这些患者的血糖水平在接受二甲双胍治疗后仍然不能得到足够的控制。试验结果表明,在接受治疗26周之后,接受7 mg或14 mg剂量司马鲁肽治疗的患者组的平均HbA1c水平分别下降1.0%和1.3%,显著优于活性对照组(0.8%, p<0.001)。同时,在26周时,7 mg和14 mg司马鲁肽组患者体重平均降低2.2公斤和3.1公斤,显著优于活性对照组(0.6公斤,p<0.01)。
“很多2型糖尿病患者虽然接受已有口服抗糖尿病疗法的治疗,仍然不能够达到目标血糖水平,”PIONEER 3试验研究员Dale Allison博士说:“从PIONEER 3试验中获得的数据令人鼓舞,它证明了口服司马鲁肽能够给HbA1c水平带来具有临床意义的改善。这款在研疗法可能成为第一款口服GLP-1受体激动剂,为2型糖尿病患者造福。”如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:司马鲁肽/索马鲁肽(RYBELSUS)治疗T2D合并肥胖患者的疗效和安全性如何?
更多药品详情请访问 司马鲁肽 https://www.kangbixing.com/drug/smlt/





 添加康必行顾问,想问就问
添加康必行顾问,想问就问