BridgeBio生物制药公司与Helsinn集团近日联合宣布,美国食品和药物管理局(FDA)已加速批准英菲格拉替尼(infigratinib),用于治疗先前接受过治疗、携带FGFR2融合或重排的局部晚期或转移性胆管癌(CCA)患者。英菲格拉替尼是一种口服、ATP竞争性、选择性FGFR酪氨酸激酶抑制剂。
在美国和欧盟,CCA每年影响约2万人,该病5年生存率仅为9%。虽然靶向疗法延长了许多类型癌症的生存期,但确诊为胆管癌的患者治疗选择极其有限,生存率很低。接受一线治疗后复发的FGFR2融合驱动型胆管癌患者,迫切需要靶向疗法进行进一步治疗。英菲格拉替尼的获批,对于这些患者来说是一个重要的里程碑。英菲格拉替尼将为FGFR2融合驱动型胆管癌患者带来一种新的靶向治疗选择。
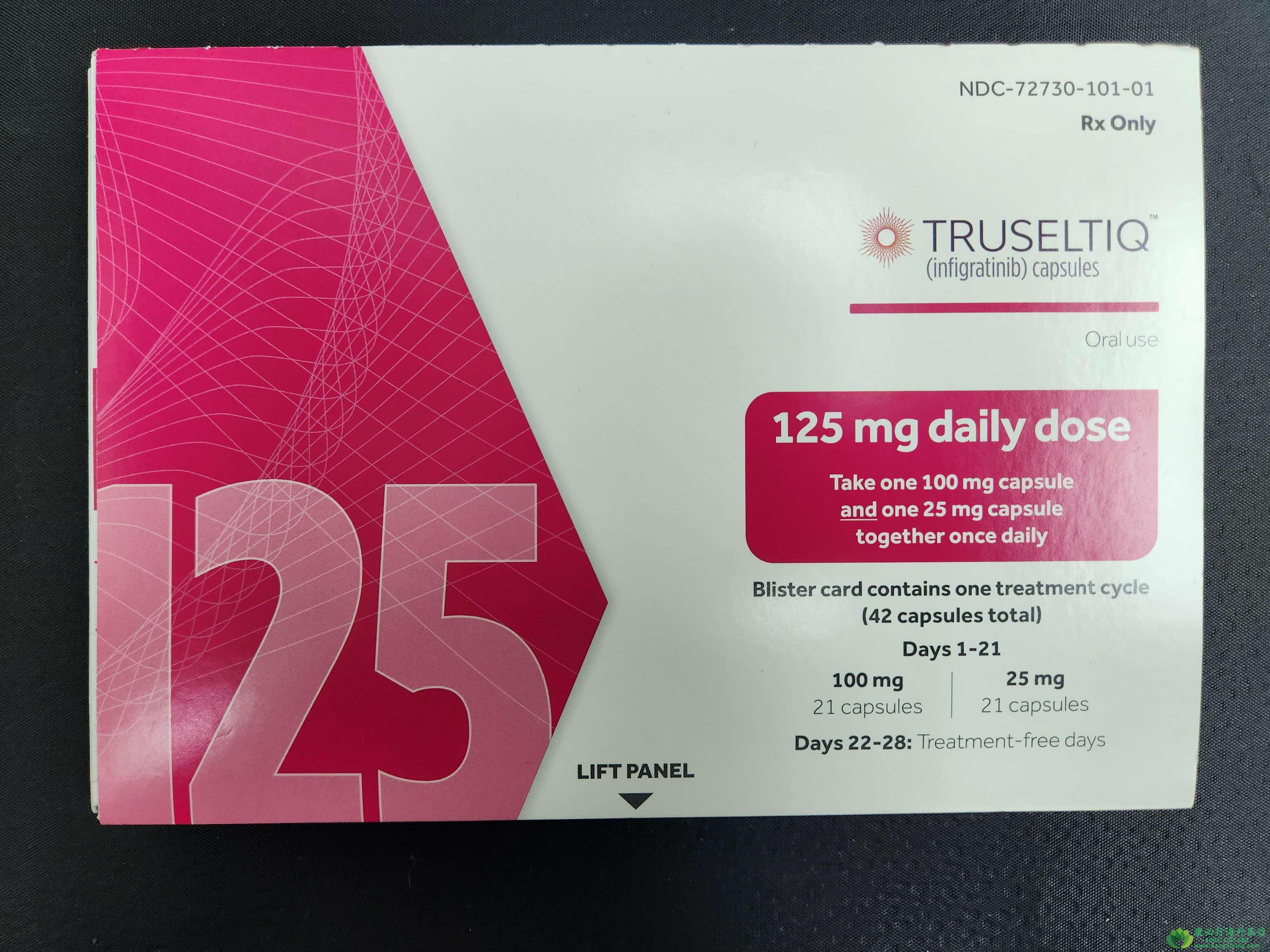
此次批准,基于一项2期临床研究的数据。该研究中,108例先前接受过至少一种疗法的晚期CCA患者,接受了英菲格拉替尼每日一次125mg治疗,28天一个疗程,每个疗程服药21天、停药7天。在这些患者中,107例(99%)为IV期CCA。所有患者至少接受过1次系统疗法。
结果显示,接受英菲格拉替尼治疗的患者中,客观缓解率(ORR)为23%(95%CI:16-32%),中位缓解持续时间(DoR)5.0个月(95%CI:3.7-9.3个月)。该研究中,英菲格拉替尼的安全性和耐受性良好。
英菲格拉替尼的活性药物成分为infigratinib,这是一种创新型、口服、成纤维细胞生长因子受体(FGFR)1-3选择性强效抑制剂,具有明确的新型化学结构及药理作用。临床研究显示,infigratinib在治疗伴FGFR2基因融合的化疗难治型胆管癌患者和伴FGFR3基因组变异的晚期尿路上皮癌患者中疗效显著。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 英菲格拉替尼 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问












