美国FDA加速批准了激酶抑制剂英菲格拉替尼(Truseltiq),用于既往接受过治疗的、不可切除的局部晚期或转移性胆管癌成人患者,要求患者存在FGFR2融合或其他重排。FDA也批准了FoundationOneCDx伴随诊断设备,以选择适合用英菲格拉替尼治疗的FGFR2融合或其他重排的患者。
英菲格拉替尼的有效性在一项多中心开放标签单臂试验中进行了评估。
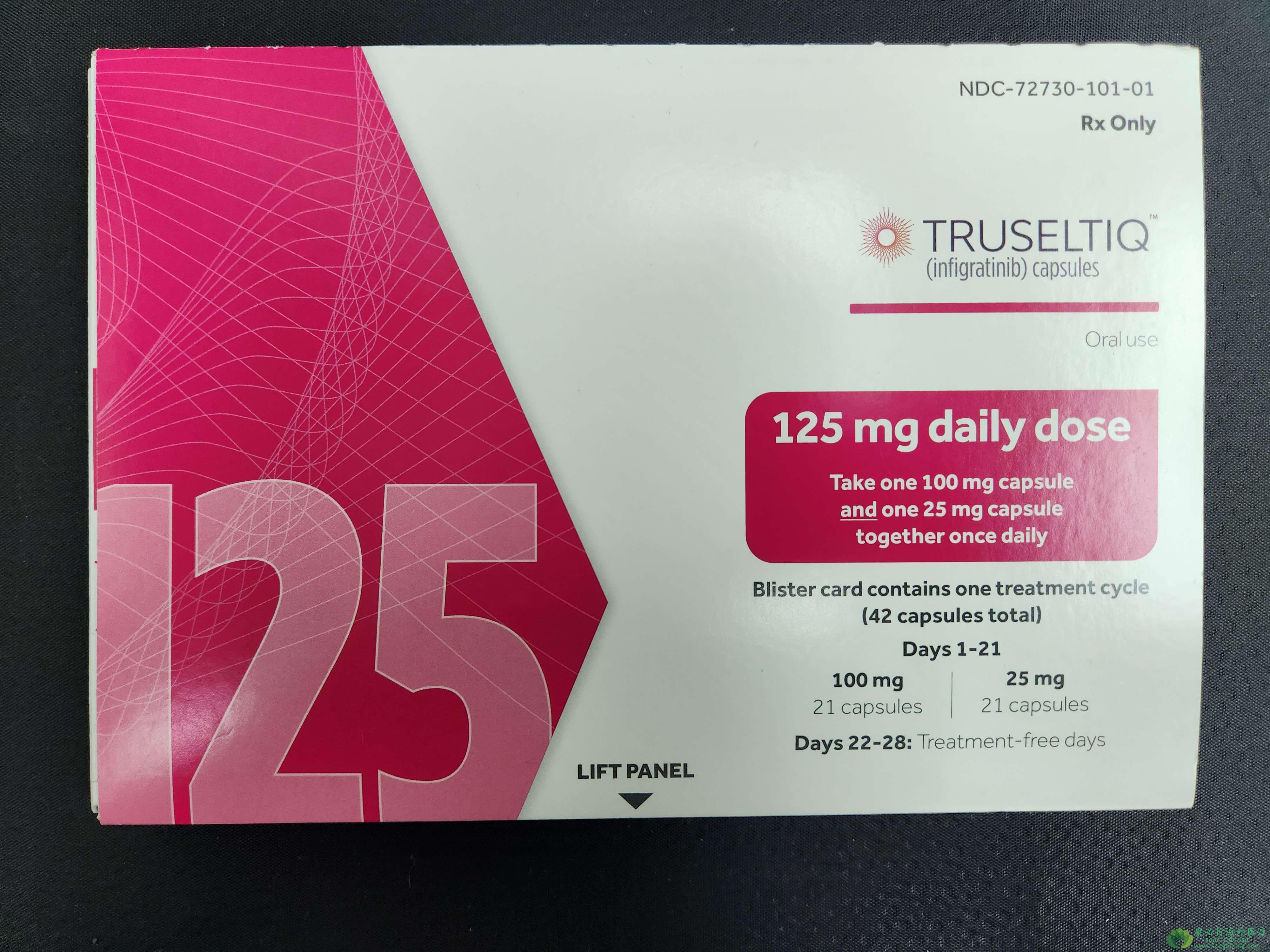
该试验招募了108名既往接受过治疗、无法切除的局部晚期或转移性胆管癌患者,这些患者存在FGFR2融合或重排。患者连续21天,每天口服一次英菲格拉替尼125mg,然后停药7天,以28天为一个周期,持续治疗直到疾病进展或出现不可接受的毒性。主要疗效评估指标是总体缓解率和缓解持续时间。
结果显示,总体缓解率为23%,其中1例患者肿瘤完全消失,24例部分缓解。中位缓解持续时间为5个月。
在缓解的患者中,8名患者疗效持续6个月或更长时间。治疗常见的不良反应有高磷血症、肌酐升高、指甲毒性、口腔炎、干眼症、疲劳、脱发、关节痛、味觉障碍、便秘、腹痛、口干、腹泻、皮肤干燥、食欲减退、视力模糊和呕吐等。
严重的不良反应包括高磷血症和视网膜色素上皮脱离,建议在治疗期间监测这些不良反应。Infigratinib的推荐剂量为每天一次125毫克,连续21天空腹口服,然后停药7天,28天为一个周期。
FGFR突变在多种疾病中都有发现,包括胆管癌、胶质瘤、乳腺癌、尿路上皮癌等多种实体瘤,以及软骨发育不全症等,目前有多种临床试验正在评估英菲格拉替尼对这些疾病的效果,相信英菲格拉替尼在FGFR突变疾病领域将大有作为!如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 英菲格拉替尼 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问












