在药物中,支架是插入血管或其他内部导管以便扩张血管以防止或减轻阻塞的任何装置。传统上,这种装置由金属网制成,并且通过进一步的手术干预而永久地保持在体内或直到被移除。甲生物可吸收的支架,(也被称为可生物降解的,或天然溶解)用于同样的目的,但是从可以溶解或在体内被吸收的材料制成。

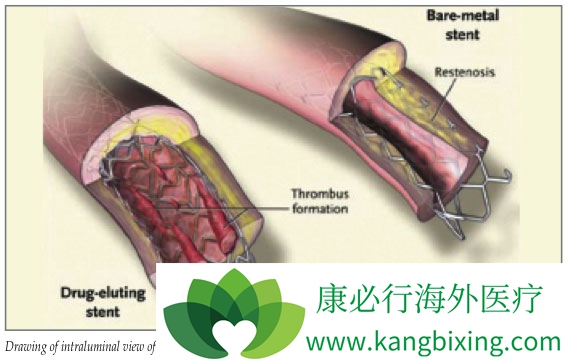
使用金属药物洗脱支架有一些潜在的缺点。这些包括对晚期支架内血栓形成的倾向,预防后期血管适应性或扩张性重建,手术血运重建的阻碍以及多层CT成像的损害。
为了克服这些潜在的缺点,一些公司正在追求生物可吸收或生物吸收性支架的开发。像金属支架一样,生物可吸收支架的放置将恢复血液流动并通过愈合过程支持血管。然而,在生物可吸收支架的情况下,支架将逐渐吸收并且从身体中良性地清除,不留下永久的植入物。
研究表明,血管愈合的最关键时期大致完成了大约三个月。因此,生物可吸收或“临时”支架的目标是在这个关键时期完全支持血管,然后在不再需要时从体内吸收。
已研究的生物可吸收支架或天然溶解支架包括金属或聚合物的基材。那些在世界各地市场获得批准并因此获得最大牵引力的产品基于与可溶性针迹中使用的聚合物相似的聚合物。
已研究的生物可吸收支架或天然溶解支架包括金属或聚合物的基材。那些在世界各地市场获得批准并因此获得最大牵引力的产品基于与可溶性针迹中使用的聚合物相似的聚合物。

金属基
金属支架候选物是铁,镁,锌及其合金。
使用基于鼠腹主动脉的体内评价方法显示铁支架,以在血管壁中产生氧化铁填充腔。这种行为明显缩小了管腔,并在支架退化后产生了内皮破裂的潜在位置。
镁是一种相对较新的生物材料,最近一直受到关注。[6]尽管有害物质降解,但已被证明在体内具有约30天的功能降解时间。这远远不及生物可吸收支架所需的三到六个月的窗口。因此,已经非常注意通过合金化,涂层等大大降低了镁腐蚀速率。[7]许多新颖的方法已经出现,以使渗透速率和析氢速度最小化(或以外行术语,腐蚀速率) 。最成功的一个涉及生物吸收性金属眼镜的创造通过快速凝固。其他替代解决方案包括开发镁- 稀土(Mg-RE)合金,其受益于RE元素的低细胞毒性。目前正在开发涂料和复杂材料加工路线,以进一步降低腐蚀速率。然而,一些问题仍然限制了Mg生物材料的进一步发展。
最近,锌显示出优异的生理腐蚀行为,每年达到20微米的基准渗透率。[9]这一贡献还认为锌合金通常达到或超过机械性能基准(即延展性和拉伸强度)。虽然有前途,但这种材料是比较新的,因此需要进一步的工作来证明锌是支架的可行基材。

基于聚合物的
基于聚合物的支架已被批准在全球一些国家使用。这些是基于聚(L-丙交酯)(PLLA),因为它能够保持径向坚固的支架随时间分解成乳酸,身体可以用于新陈代谢的天然存在的分子。其它开发的聚合物包括酪氨酸聚碳酸酯和水杨酸。[10]
自然溶解支架的一个实例是由Abbott生产的“Absorb”支架,其具有几个设计组件和特征:基底支架:与可溶性线圈类似的聚(L-丙交酯)聚合物成形为由由桥梁连接在一起的曲折箍; 药物洗脱层“:聚-D,L-丙交酯(PDLLA)和依维莫司的混合物; “标记”:在血管造影期间允许装置可视化的端部处的一对不透射线的铂标记物; “送货系统”:气球送货系统。
临床研究
临床研究表明,可再吸收支架或天然溶解支架可提供与药物洗脱支架相当的功效和安全性。具体来说,吸收天然溶解支架已经在单臂试验和随机试验中进行了研究,将其与药物洗脱支架(DES)进行比较。早期和晚期主要不良心脏事件,血运重建和支架血栓形成已经不常见,并且与药物洗脱支架类别的市场领导者Xience DES类似。现实世界患者的研究正在进行中。[15]
成像研究表明,吸收天然溶解支架开始溶解6至12个月,并在放置于动脉后2年和3年之间完全溶解。[13]仍然有两个小的铂金标记来标记原始PCI的位置。动脉能够扩张和收缩,称为血管运动,类似于两年的健康血管。[12]



 添加康必行顾问,想问就问
添加康必行顾问,想问就问