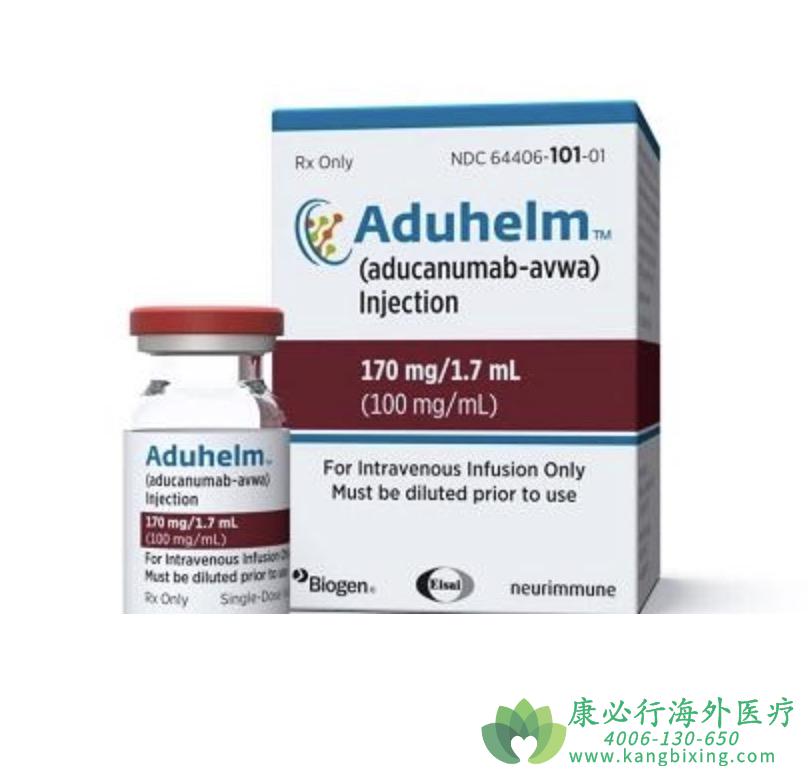
2021年06月07日,美国食品药品监督管理局FDA宣布加速批准美国渤健(Biogen)公司Aβ淀粉样蛋白抗体Aduhelm(aducanumab-avwa,阿杜那单抗注射液)用于治疗早期阿尔茨海默病(AD)患者。两项3期研究的新数据显示,在治疗长达两年半的患者中,Aduhelm持续减少两种关键阿尔茨海默病病理,此外在78周时血浆p-tau181减少的参与者的临床衰退减少了。这些数据进一步为淀粉样蛋白作为替代生物标志物的科学证据以及继续治疗的重要性提供了依据。
Aduhelm(阿杜那单抗注射液)剂量和给药方法:
1.推荐的维持剂量为10 mg/kg,静脉输注,每四周一次,每次约1小时。
2.给药前目视检查阿杜那单抗注射液稀释溶液是否有颗粒或变色。如果变色,或看到不透明或异物,请勿使用。通过0.2或0.22微米直列式过滤器,在约1小时内进行静脉输液。
3.开始治疗前,需要获取最近一年内的脑部MRI检查,阿杜那单抗注射液在任何治疗前局部浅表铁沉积、10次或更多脑微出血和/或治疗开始一年内脑出血大于1 cm的患者中的安全性尚未确定。
Aduhelm(阿杜那单抗注射液)警告和注意事项:
1.淀粉样蛋白相关影像学异常(ARIA):本品可引起淀粉样蛋白相关成像异常-水肿(ARIA-E),可在MRI上观察到脑水肿或脑沟积液,以及淀粉样蛋白相关成像异常血铁黄素沉积(ARIA-H),包括微出血和浅表铁沉积。因此,在阿杜那单抗注射液治疗的前8个剂量期间,特别是在滴定期间,建议加强对ARIA的临床警惕。如果患者出现可能提示ARIA的症状,则应进行临床评估,包括MRI检查(如有预示)
2.超敏反应:临床试验研究中有患者出现血管性水肿和荨麻疹,当首次观察到任何与超敏反应相一致的体征或症状时,应立即停止输液,并采取适当的治疗措施。
Aduhelm(阿杜那单抗注射液)不良反应:
最常见的不良反应(至少10%,与安慰剂相比发生率更高):ARIA-水肿、头痛、ARIA-H微出血、ARIA-H表浅铁质沉着症和跌倒。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 阿杜那单抗 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问