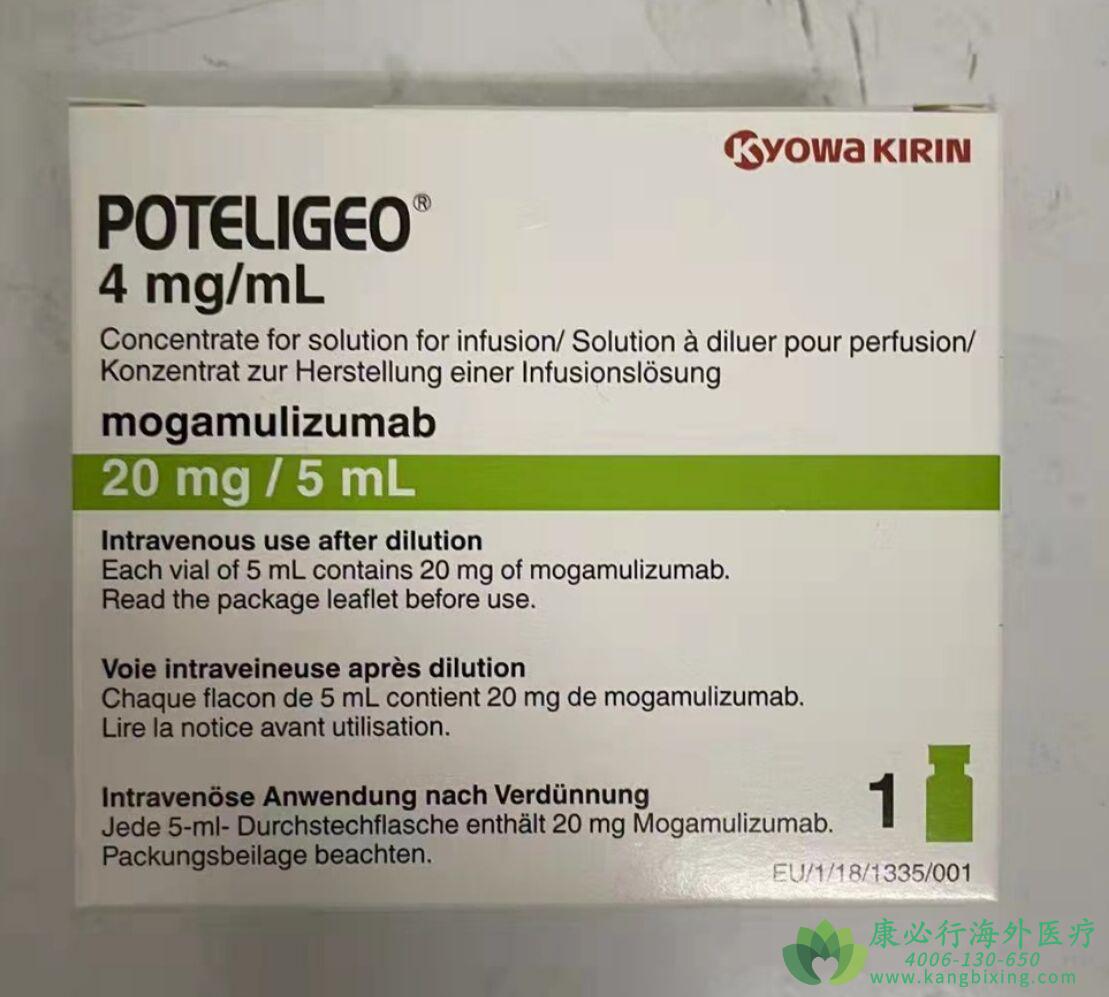
POTELIGEO(莫格利珠单抗)是一种单克隆抗体药物,是第一个靶向CCR4的生物制剂,分别于2018年8月和11月在美国和欧盟获得批准,用于治疗既往已接受至少一种系统疗法的复发性或难治性蕈样肉芽肿(MF)或塞扎里综合征(SS)成人患者。
美国食品和药物管理局批准了莫格利珠单抗适用于复发或难治性蕈样肉芽肿(MF)或塞扎里综合征(SS)的成年患者,至少接受过一次全身治疗。是基于一项随机、开放标记、多中心试验(Study 0761-010;NCT01728805),患有活动性MF或SS的患者需要基于至少一次既往全身治疗并且已经平均接受过3次既往全身治疗的事先治疗,试验包含了无论肿瘤CCR4表达状态如何的患者,排除了存在肿瘤组织学转化、接受过既往异基因造血干细胞移植或90天内自体造血干细胞移植、患有活动性自身免疫性疾病或活动性感染的患者。
该试验以1:1的比例将招募的372名患者随机分配到莫格利珠单抗组(186例;MF 56%,SS 44%)或伏立诺他组(186例;MF 53%,SS 47%)。符合条件的患者ANC≥1500/L2(≥1000/L2,如果涉及骨髓),血小板计数≥100,000/L2(≥75,000/L2,如果涉及骨髓),肌酐清除率>50 mL/min或血清肌酐≤1.5 mg/dL,肝转氨酶≤2.5倍正常值上限(ULN)(≤5倍ULN,如果淋巴瘤性肝浸润)。患者接受莫格利珠单抗,1 mg/kg作为静脉输注,在第一个28天周期的第1、8、15和22天,以及随后每个周期的第1和15天至少60分钟;或每天口服一次伏立诺他,400mg,连续服用28天,治疗一直持续到疾病进展或不可接受的毒性。允许患有疾病进展或不可接受毒性的伏立诺他治疗患者转到莫格利珠单抗组。
疗效基于研究者评估的无恶化生存期(PFS),其定义为从随机化之日到记录疾病或死亡进展的时间。其他疗效指标包括基于全球综合反应标准的总体反应率(ORR),该标准结合了来自每个疾病区间(皮肤、血液、淋巴结和内脏)的指标。该试验结果显示,患者的无进展生存期(PFS)在统计学上显著延长。根据独立审查委员会的评估,莫格利珠单抗组的预计平均PFS为6.7个月(95%CI,5.6,9.4),伏立诺他组为3.8个月(95%CI,3.0,4.7)(风险比=0.64;95%CI,0.49,0.84)。
关于安全性,莫格利珠单抗最常见的不良反应(报告的不良反应≥20%)是皮疹,输液相关反应,疲劳,腹泻,肌肉骨骼疼痛和上呼吸道感染。36%的患者出现严重不良反应,最常见的是感染(占所有患者的16%)。(报告的不良反应≥10%)包括皮肤感染、发热、恶心、水肿、血小板减少、头痛、便秘、粘膜炎、贫血、咳嗽和高血压。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:莫格利珠单抗(POTELIGEO)治疗罕见淋巴瘤是否有效?
更多药品详情请访问 莫格利珠单抗 https://www.kangbixing.com/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问