现今CAR-T的应用已不仅仅局限于CD19。在早期靶向多发性骨肉瘤的BCMA和急性淋巴白血病的CD22的临床试验中,CAR-T细胞疗法均表现出相似的抗肿瘤活性。然而,正如CD19对B细胞系一样,BCMA和CD22也存在着高度限制,其存在的组织会出现靶向毒性。迄今为止,靶向肿瘤相关抗原的尝试取得的成功十分有限。
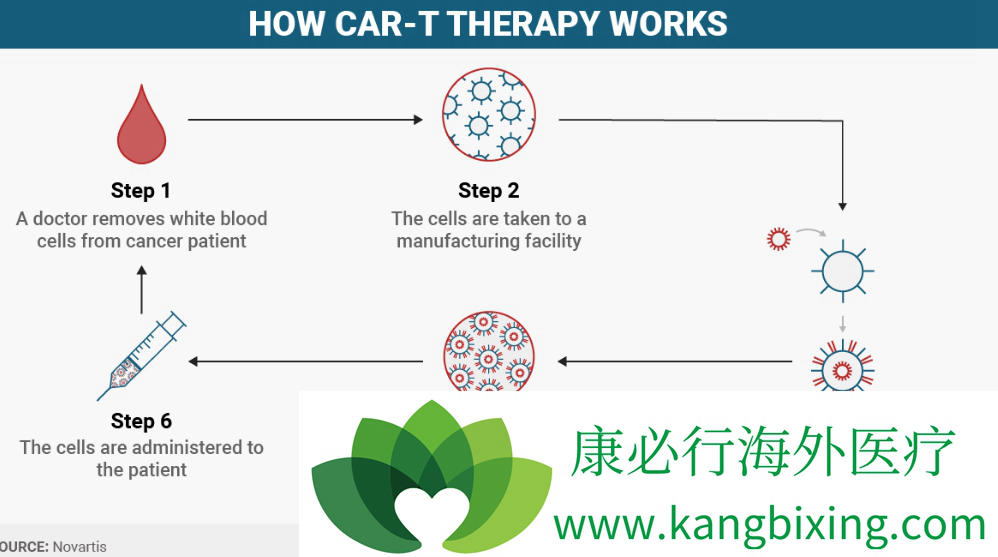
ERBB2/HER2蛋白作为酪氨酸激酶受体一员,在肿瘤中经常过表达,也是抗体或抗体-药物偶联治疗的确证靶点。首次采用CAR-T细胞靶向治疗ERBB2/HER2患者时出现了致命性的毒性。通过使用具有基于赫赛汀和CD28和4-1BB细胞内信号传导结构域的高亲和力scFV的第三代CAR,揭示出毒性主要是由于识别和杀死肺上皮细胞表达低密度的ERBB2阳性细胞所致,引发肺衰竭和大量细胞因子释放。含有scFv的较低剂量CAR-T细胞疗法较赫赛汀为基础建立的CAR的亲和力更低,治疗骨肉瘤的安全性较好,但只有轻度的临床活性。
在临床试验中,CARs靶向其它共享抗原相关实体瘤包括间皮素、癌胚抗原和GD2神经节苷脂时并未显示出值得关注的毒性,但试验中的临床抗肿瘤疗效也被限制到最低。GD2-特异CAR-T细胞在临床前试验中随着抗肿瘤活性的增强出现致死性神经毒性。局部注射靶向白介素-13受体α2的CAR-T细胞治疗多形性胶质母细胞瘤时未出现静脉注射的预期毒性,表明需要关注一些抗原瘤内注射给药方式。



 添加康必行顾问,想问就问
添加康必行顾问,想问就问