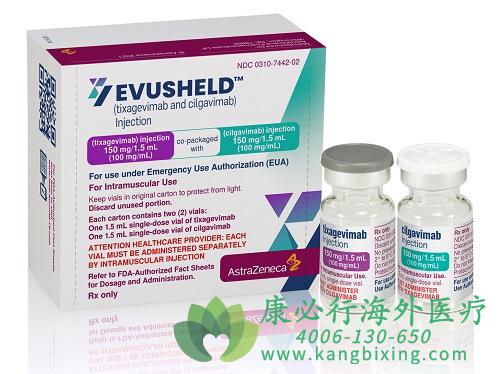
来自华盛顿大学医学院的最新临床前真实“活”病毒数据表明,Evusheld对新出现的高传染性新冠病毒奥密克戎(Omicron)变异株BA.2亚系有强效中和活性。研究还表明,Evusheld可中和Omicron BA.1、Omicron BA1.1以及迄今为止所有的关切变异株(VOC)。
恩适得(替沙格韦单抗和西加韦单抗)最初获EUA授权的给药方案参考PROVENT III期暴露前预防试验的剂量,即替沙格韦单抗和西加韦单抗各150 mg肌肉注射。2022年2月,FDA基于对Evusheld对目前美国的主要流行株Omicron BA.1和ba1.1亚变异株的体外中和活性的模型评估,认为Evusheld对Omicron BA.2变异株保留了完全的中和活性,但对BA.1.1亚变异株的中和活性降低,因此进行剂量调整,将替沙格韦单抗和西加韦单抗的剂量从150 mg增加至300 mg。
Evusheld(恩适得)作为针对新冠病毒的长效中和抗体,首先适用于用于成人和青少年(≥12岁,体重≥40kg)新型冠状病毒肺炎暴露前预防,特别是免疫功能受损或者免疫力低下人群(包括正在接受化疗的恶性血液肿瘤或其他肿瘤患者,器官移植后用药的患者,透析患者,正在使用免疫抑制药物的多发性硬化症和类风湿性关节炎等疾病患者)。
我国目前流行病株为Omicron BA.2变异株,通常只需要替沙格韦单抗和西加韦单抗各150 mg肌肉注射。
2022年6月,阿斯利康披露已将恩适得在TACKLE III期临床试验的积极成果发表在Lancet Respiratory Medicine,研究表明Evusheld可降低新冠重症和死亡风险。2022年9月欧盟批准Evusheld长效抗体组合用于治疗新冠肺炎。
TACKLE III期实验:
TACKLE是一项III期、随机、双盲、安慰剂对照、多中心试验,旨在评估单次肌肉注射600 mg剂量的Evusheld与安慰剂相比在门诊治疗轻度至中度COVID-19的安全性和有效性。该试验在美国、拉丁美洲、欧洲和日本的95个地点进行。
903名参与者按1:1随机分配接受恩适得(n=452)或安慰剂(n=451),在两次单独的连续肌肉注射中给药。参与者是患有轻度至中度COVID-19的18岁及以上成年人,出现症状的时间不超过7天且未住院。
TACKLE III期临床试验结果显示,单次肌肉注射600 mg剂量的Evusheld(替沙格韦单抗300mg和西加韦单抗300mg)在门诊治疗轻度至中度新冠患者中可将进展为重症或死亡(任何原因)的相对风险显着降低50%;
对于出现症状后三天内接受治疗的参与者,Evusheld将该风险降低了88%;
对于出现症状后五天内接受治疗的参与者,Evusheld将该风险降低了67%。
因此,300mg剂量Evusheld用于新型冠状病毒肺炎暴露前预防;600 mg剂量的Evusheld则可应用于轻度至中度新冠患者降低重症和死亡风险。
恩适得在试验中总体耐受性良好。安慰剂组的不良事件(AE)发生率高于Evusheld组(36%VS 29%)。最常见的AE是COVID-19肺炎;安慰剂组12%的参与者和Evusheld组7%的参与者发生了严重的AE。安慰剂组有6例COVID-19报告死亡,Evusheld组有3例死亡。
研究显示,在临床治疗轻度至中度新冠患者的过程中,与安慰剂相比,Evusheld明显遏制了新冠病症的恶化并且有效减少了死亡病例。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 恩适得 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问