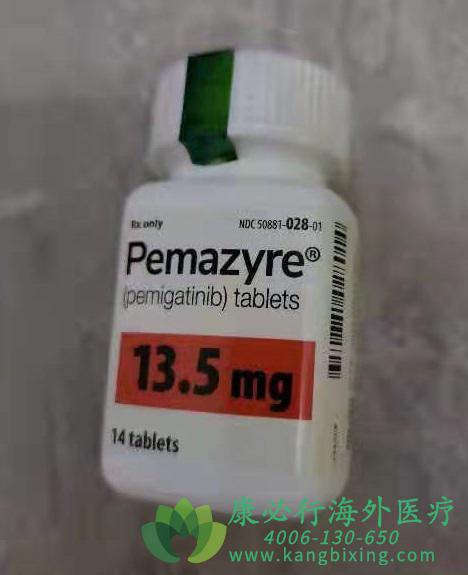
培米替尼是一种针对FGFR亚型1/2/3的强效选择性口服抑制剂。2020年4月美国食品药品监督管理局(FDA)批准Incyte公司Pemazyre用于治疗既往接受过治疗的成人晚期/转移性或不可切除的FGFR2基因融合/重排型胆管癌(通过FDA批准的检测方法确认)。
一家生物制药公司宣布,在2021年美国临床肿瘤学会(ASCO 2021)线上年会以摘要发表的形式公布培米替尼在中国晚期实体瘤人群中的1期研究结果。
本项1期研究主要目的是评价培米替尼在中国人群中的药代动力学(PK)、药效动力学(PD)征,安全性和初步疗效。
12例既往经过标准治疗失败的、携带成纤维细胞生长因子或成纤维细胞生长因子受体(FGF/FGFR)变异的晚期实体瘤患者(包括结直肠癌、胃癌、乳腺癌、胆管癌和食管癌)被纳入此项研究,按照每3周一个治疗周期(服药两周,暂停一周)口服13.5mg剂量的培米替尼。
截至2021年1月31日,所有12例受试者均至少接受过一次培米替尼治疗,安全性良好,最常发生的治疗相关不良事件(TRAE)为高磷酸血症、食欲降低和腹泻,程度均为1~2级。两例受试者报告了≥3级的TRAE,分别为低钠血症和蛋白尿。试验期间未发生导致死亡和治疗终止的不良事件。在11例疗效可评价人群中,2例受试者获得部分缓解,其中1例为携带FGFR2点突变(p.F276C)的肝外胆管癌患者,另一例为携带FGFR1点突变(p.A354V)的食管癌患者。3例受试者的最佳疗效为疾病稳定。本研究的客观缓解率(ORR)为16.7%(95%CI:2–48%),疾病控制率达到41.7%(95%CI:15–72%)。
本项研究显示培米替尼在中国人群中具有良好的安全性,同时在携带FGFR2重排和融合以外的人群中观察到了积极的疗效信号。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:培米替尼/培美替尼(PEMIGATINIB)治疗视网膜病变转移性结肠腺癌效果好?
更多药品详情请访问 培米替尼 https://www.kangbixing.com/drug/pmtn/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问