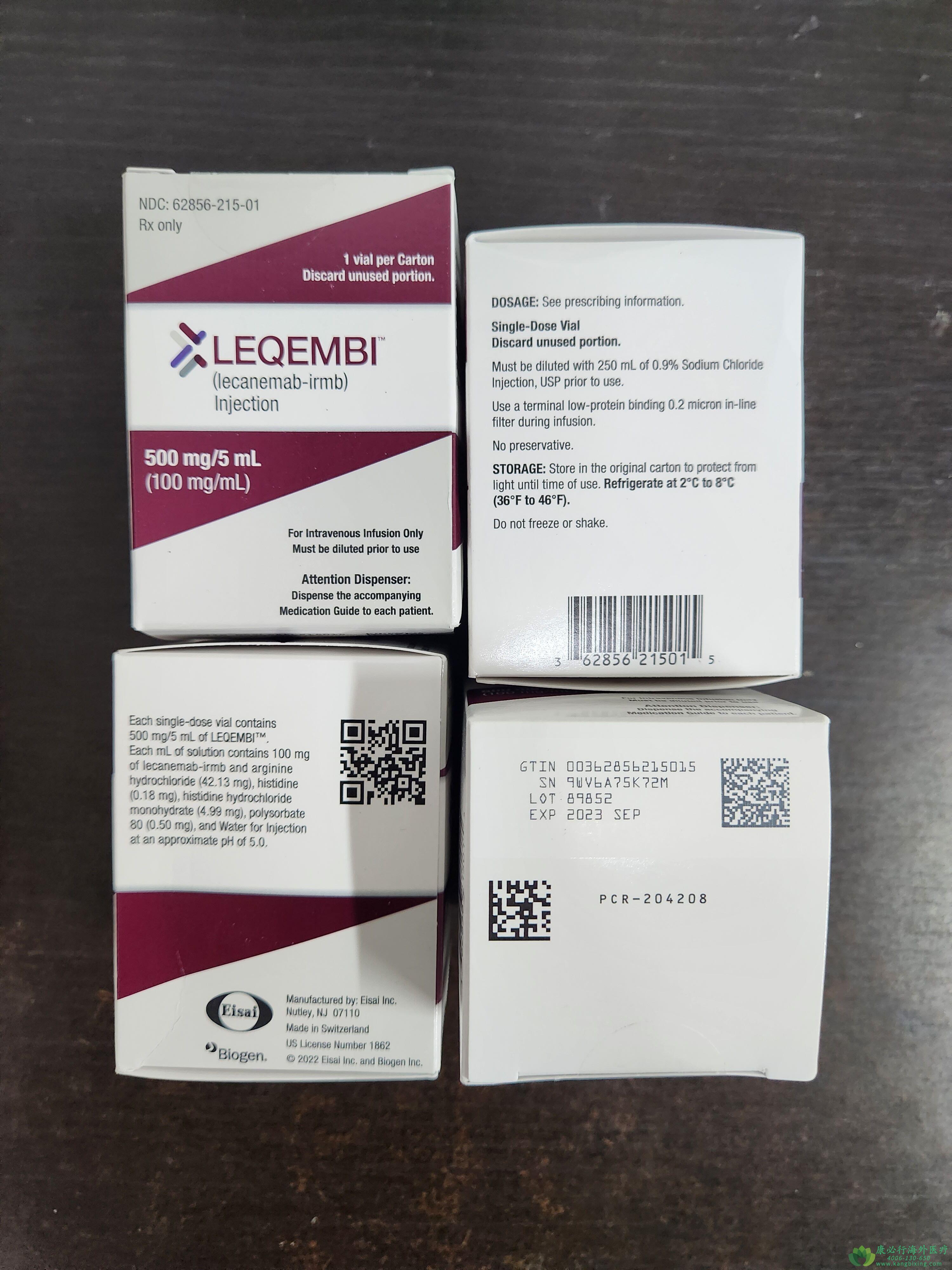
治疗阿尔茨海默病;美国FDA通过加速审批途径批准渤健(Biogen)和卫材(Eisai)联合开发的Leqembi(lecanemab-irmb),用于治疗阿尔茨海默病(AD)。Leqembi仑卡奈单抗是继Aducanumab后,全球第2款获批上市的靶向β淀粉样蛋白的创新疗法。FDA曾授予此疗法快速通道资格、优先审评资格、突破性疗法认定。一项双盲、安慰剂对照组、平行组别的2b期临床试验结果。研究人员在一项856名阿尔茨海默病患者的双盲、安慰剂对照、平行组、剂量探索研究中评估了Leqembi的疗效。在轻度认知功能障碍或疾病轻度痴呆阶段并证实存在β淀粉样蛋白病理学的患者中开始治疗。数据结果显示,与安慰剂组相比,接受治疗的患者β淀粉样蛋白斑块出现显著的剂量和时间依赖性减少,接受批准剂量lecanemab(10 mg/kg,每2周一次)的患者从基线至第79周的脑淀粉样蛋白斑块出现统计学显著减少,而安慰剂组β淀粉样蛋白斑块没有减少。
Leqembi仑卡奈单抗治疗应在轻度认知障碍或轻度痴呆阶段的患者中开始,这些人群是在临床试验中开始治疗的。没有比研究更早或更晚的疾病阶段开始治疗的安全性或有效性数据。根据在接受Leqembi治疗的患者中观察到的淀粉样β斑块的减少,这一适应症被批准为加速批准。
Leqembi(lecanemab-irmb)警告和注意事项:
1.淀粉样蛋白相关的影像异常
Leqembi可导致淀粉样蛋白相关的成像异常-水肿(ARIA-E)和-含铁血黄素沉积(ARIA-H)。ARIA-E可以在MRI上观察到,表现为脑水肿或脑沟积液,ARIA-H表现为微出血和表面铁质沉着。ARIA通常无症状,尽管很少会发生严重的危及生命的事件,包括癫痫发作和癫痫持续状态。已报告的ARIA相关症状可能包括头痛、意识模糊、视觉变化、头晕、恶心和步态困难。也可能出现局灶性神经功能缺损。与ARIA相关的症状通常会随着时间的推移而消失。
Leqembi(lecanemab-irmb)输液相关反应:
1.在Leqembi中观察到输注相关的反应:20%(32/161);安慰剂:3%(8/245),Leqembi治疗患者中的大多数病例(88%,28/32)发生在第一次输注时。所有输液相关反应的严重程度为轻度(56%)或中度(44%)。输注相关反应导致2%(4/161)接受Leqembi治疗的患者停药。输液相关反应的症状包括发热和流感样症状(寒战、全身疼痛、颤抖和关节痛)、恶心、呕吐、低血压、高血压和氧饱和度下降。
2.第一次输注后,38%接受Leqembi治疗的患者出现淋巴细胞计数短暂下降至<0.9 x109/L,相比之下,安慰剂组为2%,22%的Leqembi治疗患者的中性粒细胞计数暂时增加至>7.9 x109/L,而安慰剂组为1%。
3.如果出现输液相关反应,可能会降低输液速度,或中断输液,并根据临床指征开始适当的治疗。可考虑在未来输注前使用抗组胺药、对乙酰氨基酚、非甾体抗炎药或皮质类固醇进行预防性治疗。
Leqembi仑卡奈单抗(lecanemab-irmb)不良反应:
在研究201中,15%接受Leqembi治疗的患者因不良反应而停止研究治疗,相比之下,接受安慰剂治疗的患者为6%。导致Leqembi停药的最常见的不良反应是输注相关反应,导致2%(4/161)的Leqembi治疗患者停药,相比之下,1%(2/245)的安慰剂治疗患者停药。
2.在研究1中,在接受Leqembi治疗的≥5%的患者(N=161)中报告的最常见的不良反应比安慰剂组(N=245)高≥2%,这些不良反应为输注相关反应(Leqembi:20%;安慰剂:3%)、头痛(Leqembi:14%;安慰剂:10%)、ARIA-E(Leqembi10%;安慰剂:1%)、咳嗽(Leqembi:9%;安慰剂:5%)和腹泻(Leqembi:8%;安慰剂:5%)。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:仑卡奈单抗(LEQEMBI/LECANEMAB)的药物副作用有哪些?
更多药品详情请访问 仑卡奈单抗 https://www.kangbixing.com/drug/lkndk/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问












