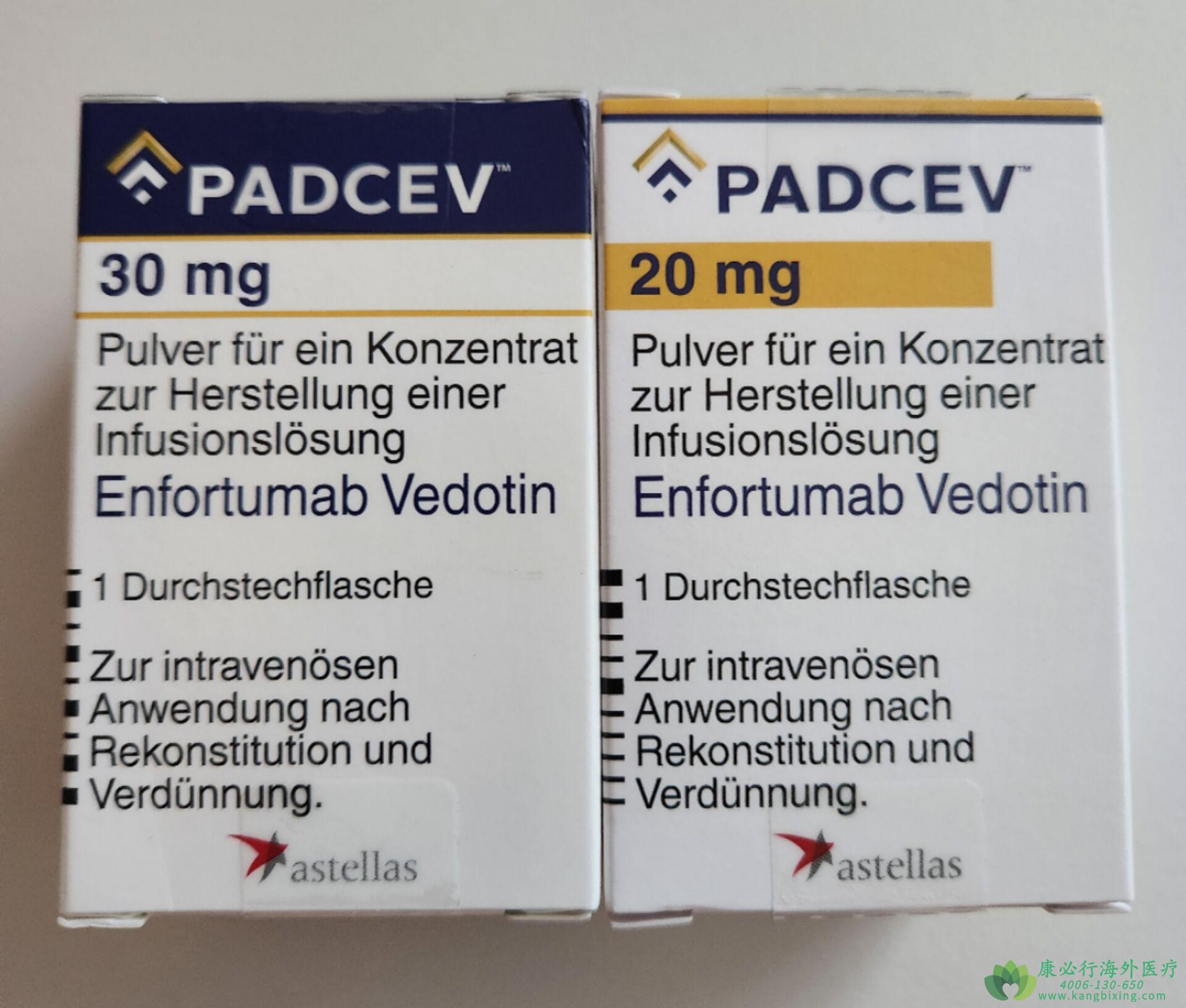
安斯泰来/Seagen宣布,中国国家药品监督管理局(NMPA)药品审评中心(CDE)已受理Enfortumab Vedot(商品名恩诺单抗(PADCEV))用于治疗既往接受过PD-1/PD-L1抑制剂和含铂化疗治疗的局部晚期或转移性尿路上皮癌(la/mUC)患者的生物制品上市许可申请,这是国内首款申报上市的靶向Nectin-4 ADC,也是全球唯一一款已经问世的Nectin-4 ADC靶向药物。
恩诺单抗(PADCEV)的成功及nectin-4 ADC的市场趋于空白,目前越来越多的药企开始对nectin-4靶点投来欣赏的目光,入局者逐渐增多,特别是中国的Biotech,参与的热情不断高涨。聚焦国内,目前迈威生物研发进度靠前,百奥泰生物、石药集团紧随其后,此外,君实生物也开始布局该靶点。
2019年12月,FDA批准了恩诺单抗(PADCEV)用于治疗既往在手术前(新辅助)或手术后(辅助)、局部晚期或转移性背景下接受过PD-1或PD-L1抑制剂和含铂化疗的局部晚期或转移性尿路上皮癌的成人患者。
2021年7月,FDA授予恩诺单抗(PADCEV)在美国的常规性获批,且同时依据II期临床试验EV-201 cohort 2的结果,扩展了适应症,用于不适宜顺铂治疗但曾受过PD-1/PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌患者。临床数据显示,恩诺单抗(PADCEV)治疗迅速缩小了大多数患者的肿瘤,客观缓解率(ORR)为44%,完全缓解率为(CR)12%,中位缓解持续时间(DoR)为7.6个月。
2022年12月,恩诺单抗(PADCEV)联合Keytruda治疗不适合接受含顺铂化疗的局部晚期或转移性尿路上皮癌的sBLA获FDA受理。恩诺单抗(PADCEV)联合免疫治疗或将成为尿路上皮癌患者治疗的新方向,为顺铂不耐受的晚期尿路上皮癌患者提供了新的治疗选择。研究指出,恩诺单抗(PADCEV)+Keytruda有效率高达73.3%,1年总生存(OS)率为81.6%。
此次恩诺单抗(PADCEV)在中国的上市申请基于一项单臂、开放标签、多中心的II期临床试验EV-203试验(NCT04995419)的数据。
该试验旨在评估恩诺单抗(PADCEV)治疗既往接受PD-1/PD-L1抑制剂和含铂化疗治疗的局部晚期或转移性尿路上皮癌的中国患者的疗效、安全性和药代动力学特征。
结果显示,EV-203达到了其主要终点,即与历史对照相比,经独立审查委员(IRC)确认的接受恩诺单抗(PADCEV)单药治疗患者的客观缓解率(ORR)达到统计学意义,该研究的有效性和药代动力学数据与全球数据一致。
目前,恩诺单抗(PADCEV)已在美国、日本以及欧洲等主流国家上市,而国内Nectin-4 ADC靶向药物市场依旧空白。如果恩诺单抗(PADCEV)顺利获批,将有望填补空白,开辟中国Nectin-4 ADC靶向药物新时代。
恩诺单抗(PADCEV)由Seagen和安斯泰来联合开发,ADC链接子技术来自Seagen,靶点鉴定工作由安斯泰来完成。恩诺单抗(PADCEV)是一种首创的ADC药物,由靶向Nectin-4的人源IgG1单克隆抗体Enfortumab与细胞毒制剂单甲基奥瑞他汀E偶联而成。
恩诺单抗(PADCEV)是一种被称为抗体-药物结合物的疗法。该疗法由Seagen和Astellas开发,于2019年底获得美国初步批准,用于膀胱癌的晚期治疗。恩诺单抗(PADCEV)和Keytruda联合用药的加速批准,对美国约8000至9000名局部晚期或转移性尿道上皮癌患者来说是一个重要的里程碑,这些患者不适合接受含顺铂的化疗。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:恩诺单抗(PADCEV/ENFORTUMAB)相关信息说明介绍
更多药品详情请访问 恩诺单抗 https://www.kangbixing.com/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问