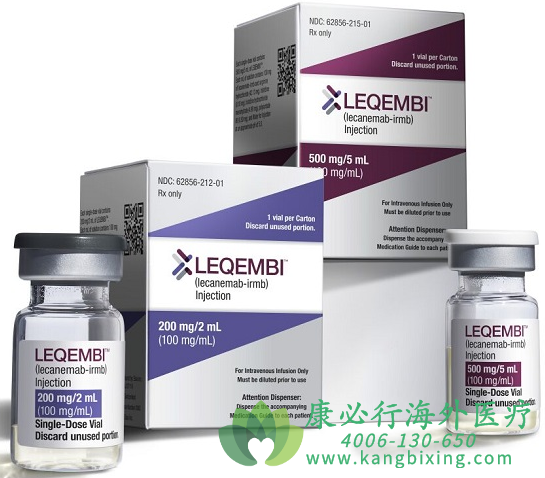
3月6日,卫材与渤健共同宣布,FDA已受理仑卡奈单抗(商品名:Leqembi)的补充生物制品许可申请(sBLA)并授予其优先审评,以将仑卡奈单抗用于治疗阿尔茨海默症(AD)的加速批准转为完全批准,PDUFA日期为2023年7月6日。FDA正计划召开咨询委员会会议讨论这一申请,但尚未公布具体的会议日期。
FDA此次批准是基于2期数据,这些数据表明仑卡奈单抗减少了Aβ斑块在大脑中的积累,这是AD的一个决定性特征。利用大型全球确认性3期临床试验Clarity AD的数据,卫材计划向FDA提交补充生物制剂许可申请,以便在传统途径下进行审批。
Clarity AD研究是一项多中心、双盲、3期大型全球验证性试验,共纳入1795名早期阿尔茨海默病受试者。根据11月底卫材公布的最新数据,该研究达到了主要终点(CDR-SB),仑卡奈单抗显示在减少临床衰退方面具有高度显著统计学意义。在安全性方面,仑卡奈单抗组26.4%的受试者出现输液相关反应,12.6%受试者出现淀粉样蛋白相关成像异常,伴有水肿或积液。研究者认为,需要更长的试验来确定仑卡奈单抗治疗早期阿尔茨海默病的疗效和安全性。
Clarity AD研究根据神经变性的生物标志物评估结果显示,仑卡奈单抗改善了星形胶质细胞活化的标志物——血清胶质纤维酸性蛋白(GFAP)和突触功能障碍的标志物——脑脊液(CSF)神经颗粒素,且患者经治疗后均恢复至正常水平,而仑卡奈单抗和安慰剂之间的CSF或血清神经纤维轻链无显著差异。
目前,仑卡奈单抗的定价为2.65万美元/年。美国医保方(CMS)曾表态在Lecanemab全面批准时可能会考虑扩大覆盖范围。
Lecanemab(仑卡奈单抗)是美国的渤健(Biogen)和日本的卫材(Eisai)公司一款备受关注的新药,也是针对阿尔茨海默病的治疗方案之一。与Donanemab不同的是,仑卡奈单抗采用了一种叫做单克隆抗体的技术,针对一种叫做淀粉样蛋白的蛋白质来干预AD的发展。仑卡奈单抗通过与淀粉样蛋白结合,可以选择性中和并清除导致阿尔茨海默病神经病变的可溶且有毒性的Aβ聚集体,减少它们对神经细胞的损害,从而期望改善病情和减缓疾病进程。因此,仑卡奈单抗可能对AD病理过程产生积极影响并减缓疾病发展进程。
临床试验中,仑卡奈单抗已经取得了一些令人鼓舞的研究成果。研究数据显示,仑卡奈单抗可减少早期阿尔茨海默病的淀粉样蛋白标志物,治疗18个月患者认知和功能指标的下降程度比安慰剂低。其在改善认知功能、延缓认知能力下降的速度以及减少Aβ斑块积累方面表现出相当潜力。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 仑卡奈单抗 https://www.kangbixing.com/drug/lkndk/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问