依库珠单抗治疗儿童重症肌无力新适应症获欧盟批准;全身型重症肌无力可发生于任何年龄,对儿童的影响可能是毁灭性的,这些患者以前没有靶向治疗方案来帮助控制病情,家庭长期以来一直在等待解决方案。全身型重症肌无力(gMG)是一种罕见的自身免疫性疾病,其特征是肌肉功能丧失和严重肌无力。最初症状可能包括言语不清、复视、眼睑下垂和缺乏平衡;随着疾病的进展,这些通常会导致更严重的症状,例如吞咽障碍、窒息、极度疲劳和呼吸衰竭。
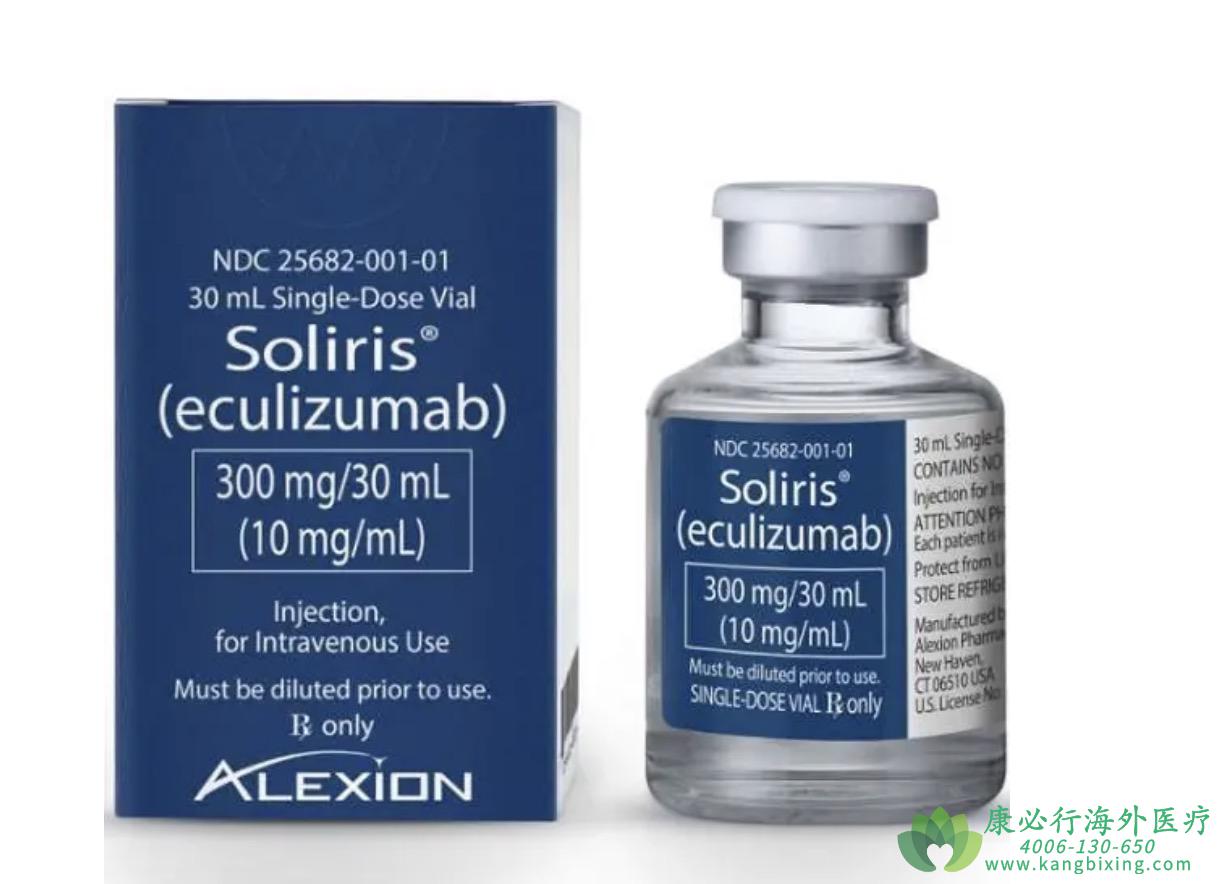
2023年7月27日,依库珠单抗(eculizumab)在欧盟(EU)获得批准扩大应用范围,可用于治疗抗乙酰胆碱受体(AChR)抗体阳性的6至17岁儿童和青少年的难治性全身性重症肌无力(gMG)。这是欧盟首个批准用于治疗患有该疾病的儿科患者的靶向疗法。
80%的全身型重症肌无力患者的AChR抗体呈阳性,这意味着他们会产生与神经肌肉接头(NMJ)信号受体结合的特异性抗体(抗AChR)。这种结合会激活补体系统,补体系统是人体免疫系统的重要组成部分,但当补体以不受控制的方式被激活,可能导致机体攻击自身健康细胞。
依库珠单抗(Eculizumab)是全球首款获批的C5补体抑制剂,能够通过选择性抑制末端补体C5的激活来发挥作用。欧盟委员会的批准遵循了人用药品委员会(CHMP)的积极意见,并基于依库珠单抗在难治性全身性重症肌无力儿科患者中进行的III期试验结果,这是一项为期26周的开放标签、多中心III期试验,评估了依库珠单抗在11名12至17岁患者中的安全性和有效性。
试验参与者要求年龄大于6岁,小于18岁,经确诊为难治性重症肌无力,且抗AChR抗体血清学检测呈阳性,之前曾接受过一年或更长时间的免疫抑制治疗失败或需要维持性血浆置换(PE)或静脉注射免疫球蛋白(IVIg)来控制症状,进入试验时重症肌无力定量(QMG)评分至少为12。
在试验中,依库珠单抗证明了对难治性全身性重症肌无力儿科患者的临床益处,在第26周时显示,定量重症肌无力(QMG)总分较基线变化的主要终点显着改善(-5.8[95%CI-8.4,-3.13],p<0.0004)。
安全性方面,依库珠单抗在儿童患者中的疗效和安全性与在成人患者中的表现一致。常见的不良反应是头痛和鼻咽炎。
依库珠单抗新适应症的获批帮助解决罕见病未得到满足的医疗需求,为受全身型重症肌无力影响的儿童和青少年提供了改善治疗结果的希望。费城儿童医院医学博士JohnF.Brandsema表示:“这项批准标志着治疗难治性全身性重症肌无力儿科患者取得了重大进展。”如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 依库珠单抗 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问