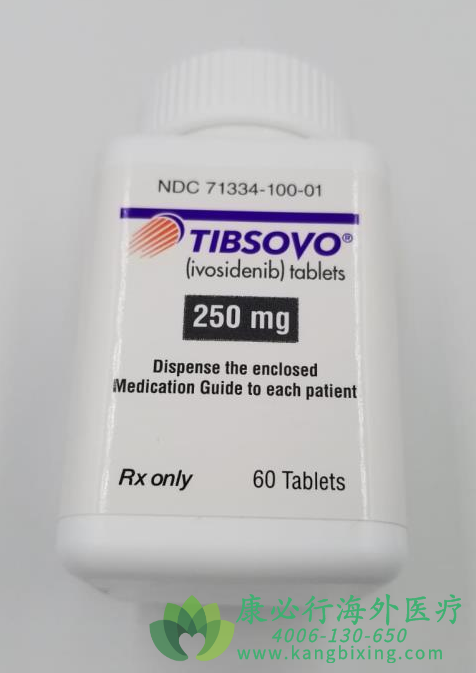
艾伏尼布/拓舒沃(Tibsovo/ivosidenib)是全球首个且目前唯一获批的靶向疗法,用于治疗携带IDH1突变的复发或难治性骨髓增生异常综合征(MDS)。基于艾伏尼布/拓舒沃(Tibsovo/ivosidenib)在IDH1突变的复发性或难治性MDS患者(n=18)中关键性的I期开放标签临床研究结果,FDA批准了该项适应症。研究结果显示,在艾伏尼布/拓舒沃(Tibsovo/ivosidenib)治疗组中,患者完全缓解率(CR)为38.9%,客观缓解率(ORR)为83.3%。
此外,达到CR的中位时间为1.9个月(。在数据截止日期时,CR的中位持续时间尚未达到,而中位总生存期为35.7个月。此外,基线时9名患者红细胞或血小板输血依赖,其中66.7%(n=6)在基线后任何≥56天不再依赖输血。总体而言,治疗相关的不良事件与艾伏尼布/拓舒沃(Tibsovo/ivosidenib)此前报道的安全性特征一致。
在美国,每年有约1.6万人被诊断患有MDS。大约3.6%的MDS患者携带IDH1突变,该突变为一种早期的“驱动”突变。对于携带IDH1突变的MDS患者,其预后通常与较差的整体疗效和更高的进展成为急性髓系白血病(AML)的风险相关。
艾伏尼布/拓舒沃(Tibsovo/ivosidenib)已被美国FDA授予突破性疗法认定,用于治疗携带IDH1突变的成年R/R骨髓增生异常综合(MDS)患者,并被授予优先审查资格。优先审查资格通常授予能显著改善治疗、诊断或预防严重疾病的有效性或安全性的药物,并能加速审批。
艾伏尼布/拓舒沃(Tibsovo/ivosidenib)是一种针对特定的靶点异柠檬酸脱氢酶1(IDH1)突变的精准疗法。艾伏尼布/拓舒沃(Tibsovo/ivosidenib)已在美国、欧盟、澳大利亚、阿拉伯联合酋长国(UAE)和中国获得了批准。
在美国,艾伏尼布/拓舒沃(Tibsovo/ivosidenib)已获批准用于治疗携带IDH1突变的复发或难治性AML成人患者、新诊断携带IDH1突变的AML成人患者(年龄≥75岁或伴有合并症无法接受强化诱导化疗的患者)、携带IDH1突变的复发或难治性MDS成人患者、以及对先前接受过治疗的携带IDH1突变的胆管癌患者。
在中国,艾伏尼布/拓舒沃(Tibsovo/ivosidenib)已获批准用于治疗携带易感IDH1突变的成年复发性或难治性急性髓系白血病(AML)患者。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!



 添加康必行顾问,想问就问
添加康必行顾问,想问就问